UHA HN 04-01(phaseⅡ)
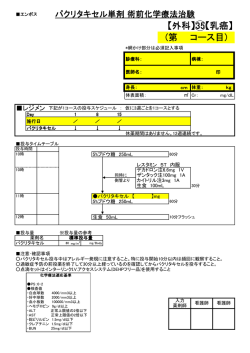
UHA HN 04-01(phaseⅡ) T2下咽頭癌に対する5FU, Nedaplatin(NDP)と放射線治療の交替療法 第II相試験 研究グループ: 主任研究者 : 愛知県がんセンター病院 放射線治療部 不破 信和 統計解析責任者: 静岡県立大学大学院薬学研究科医療薬学専攻 大門 貴志 支援機構・助成: 厚生労働省がん研究助成(計画研究14-15) 研究事務局 : 愛知県がんセンター病院 放射線治療部 登録開始日 : 2004年8月 登録終了日:2007年7月末 追跡終了日 : 最終症例登録後2年間 研究概要 シェーマ 未治療の下咽頭癌患者(T2N0, T2N1) 20-75才,PS 0-2 インフォームド・コンセント 登録 目標症例数 55例 登録期間 3年 化学療法(5FU, NDP)2コース+放射線治療(計66.6Gy) 交替療法 治療終了後 腫瘍縮小効果判定 原発巣CR 再発なし 無治療 原発巣のみnon-CR 再発あり 頸部リンパ節 のみnon-CR または再発 後治療自由 追跡 追跡期間 最終症例登録から2年後まで 研究目的 UICCのTNM分類(2003年度版)におけるT2 下咽頭癌を対象として、化学療法(5FU、 Nedaplatin)と放射線治療との交替療法の有効性及び安全性を多施設で評価・検討する。主 要エンドポイントは原発巣無増悪生存期間、副次エンドポイントは、総合腫瘍縮小効果、 全生存期間、喉頭温存生存期間、治療完遂割合、有害事象の発生頻度と重篤度である。 対象症例 (1) 病理組織学的に扁平上皮癌が確認されている下咽頭癌 (2) UICCのTNM分類(2003年度版)で、臨床病期T2と診断されている (3) 年令が20才以上75才未満である (4) 頸部リンパ節転移が、N0, N1。ただし、登録前の頸部廓清術の有無は問わない (5) ECOG版の Performance Status (PS)は0-2である (6) 初回治療例である。 (7) 他のがん腫に対する頸部への放射線治療の既往がない (8) 主要臓器の機能が以下の基準を満たしている(登録前10日以内) 白血球数 好中球数 血小板数 ヘモグロビン 血小板数 AST(GOT)及びALT(GPT) 血清クレアチニン 総ビリルビン 心電図 PaO2 3,000/mm3以上 1,500/mm3以上 10万 / mm3以上 8g/dL以上 10万 / mm3以上 各施設の正常域の上限2.5倍以下 1.5mg/dL以下 2.0 mg/dL以下 正常 65mmHg以上 (9) 重篤な肺、肝、心、代謝、神経疾患の既往がない。 (10) 試験参加について患者本人から文書で同意が得られている エンドポイント Primary endpoint : 原発巣無増悪生存期間 Secondary endpoint : 総合腫瘍縮小効果,全生存期間,喉頭温存生存期間, 治療完遂割合,有害事象の発生頻度と重篤度 予定症例数、登録期間、追跡期間 予定症例数: 55例 追跡期間 登録期間: 3年間(2004年8月~2007年7月末) : 最終登録終了後2年 中間解析 本臨床試験の安全性を早期に評価するために、適格症例20例の「症例報告書(治療中から 治療終了時)」が回収された時点で中間解析を行う。中間解析中も症例の登録は継続する。 このときの中間解析において、Grade4の血液毒性あるいはGrade4の粘膜炎(口内炎/咽頭炎) のいずれかが3例以上の適格症例に発現していた場合には、プロトコル治療の安全性を否 定し、本臨床試験を中止する。 因みに、上記のいずれかの毒性の真の発現率を5%としたとき、適格症例20例のうち3例以 上の適格症例に毒性が発現する確率は5%未満である。 登録状況 施設登録:4施設 症例登録:7症例(2006年12月末現在)
© Copyright 2026