日本語 - ロシュ・アプライド・サイエンス
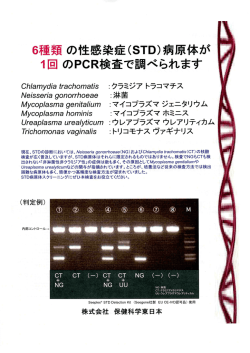
Tech Note qPCR vol. 2. リアルタイム PCR を用いた インフルエンザウイルスの 網羅的検出法 独立行政法人 国立病院機構 新潟病院 臨床検査科 医化学主任 栁田 光利 先生 2014年11月 インフルエンザウイルスの検査法は、一般的にイムノクロマト法を用 いた迅速抗原検査キットが POCT(point of care testing) として普 及しています。キットは年々改良され、A 型と B 型の他に、インフ ルエンザ (H1N1)2009 の亜型測定も可能なキットも開発されていま す。しかし、その感度および特異度は、必ずしも十分であるといえ ないのが現状です。 当院では筋ジストロフィーや神経難病により呼吸機能が低下した 患者や重症心身障害児患者などの易感染性患者が多数入院し ており、従来から流行期には厳重な感染予防対策を要してきまし た。2009 年に起きた新型インフルエンザ〔 現、インフルエンザ (H1N1)2009〕のパンデミックでは、いち早くリアルタイム PCR 検 査法を導入し、早期診断と感染拡大防止対策を講じました。当時 ロシュ・ダイアグノスティックス社 ( 以下、ロシュ社)より発売され た「RealTime ready Swine Inf A/H1N1 Detection Set」は、新型 インフルエンザとその他の A 型季節性インフルエンザの鑑別が可能 な遺伝子検出キット(研究用)であり、早期診断に十分役立ちま した。しかし、2010/11 シーズンにおける新型インフルエンザの流 行は、季節外れの大規模流行もみられず、厚生労働省はその取り 扱いを季節性インフルエンザに移行しました。 このような状況下で、我々は臨床的にインフルエンザ脳症が疑われ た 1 症例を経験しました。 症例の迅速抗原法は A 型 B 型ともに 陰性であり、ロシュ社の遺伝子測定キットも A 型陰性でしたが、後 日、外部機関による遺伝子解析において B 型インフルエンザ感染 と判明しました。インフルエンザ脳症は、重篤な脳障害や死亡の 原因となるため、その早期診断は特に小児科領域において重要と なります。 この経験を踏まえ、インフルエンザウイルスの高感度測定とその院 内検査の必要性を再認識し、A 型の亜型および B 型をリアルタイ ム PCR 法で検出することが可能な測定法を構築しました。 今回、 これらの測定方法について紹介致します。 1 方法 _________________________________________ ウイルス核酸抽出 ロシュ社製の自動核酸精製機である MagNA Pure Compact を使 用し、鼻腔拭い液、あるいは咽頭拭い液からウイルス核酸を抽出 しました。抽出には当精製機専用の MagNA Pure Compact Total Nucleic Acid Isolation Kit を用い、メーカーの推奨プロトコールに 従いました。 サンプル以外のマスターミックスを作成し、それを 18ul 分注後、 RNA サンプルまたはプラスミドスタンダードを 2ul 加え、合計 20ul のボリュームで実施しました(Table 2) 。それぞれのウイルス亜型や 内部コントロールを特異的に検出するプライマーや加水分解プロー ブの配列は WHO のインフルエンザウイルス診断プロトコールに記 載された配列を元に合成しました (Table 3) 。 リアルタイム PCR ウイルス核酸はロシュ社製の研究用リアルタイム PCR 装置である LightCycler® 480 を用いて検出しました。リアルタイム PCR には加 水分解プローブ法を用い、それぞれのウイルス亜型ごとに最適化し たプロトコールで実施しました (Table 1) 。反応液組成はまず RNA 陽性コントロール TBIO 法 1 を用いて、GenBank の登録情報に基づく株の塩基配列 を持ったプラスミドスタンダードを人工的に作成し、その希釈系列か ら検量線を得ました。これにより、標的遺伝子の半定量を行う事も できました。 Table 1; PCR プロトコール A(H1N1)2009 A(H3N2) Former seasonal A(H1N1), GAPDH Influenza type A Influenza type B RT 45℃ 15m 50℃ 8m 50℃ 8m 45℃ 15m 60℃ 8m Initial Denaturation 95℃ 30s 95℃ 30s 95℃ 30s 95℃ 30s 95℃ 30s Amplification(50cyccle) 95℃ 10s 55℃ 10s 72℃ 20s 94℃ 1s 56℃ 72s 95℃ 10s 55℃ 10s 72℃ 20s 95℃ 1s 55℃ 20s 72℃ 20s 94℃ 20s 62℃ 60s Table 2; PCR 反応液の調整 A(H1N1)2009 A(H3N2) Former seasonal A(H1N1) Influenza type A Influenza type B Human internal control 11.2 10.2 10.6 11.2 10.6 10.6 0.4 0.4 0.4 0.4 0.4 0.4 DW Enzyme 1* Buffer 2* 4.0 4.0 4.0 4.0 4.0 4.0 Fw Primer(10pmol/ul ) 1.0 1.2 1.0 1.0 1.0 1.0 Rv Primer(10pmol/ul ) 1.0 1.2 1.0 1.0 1.0 1.0 Probe(10pmol/ul ) 0.4 1.0 1.0 0.4 1.0 1.0 RNA Sample 2.0 2.0 2.0 2.0 2.0 2.0 * RealTime ready RNA Virus Master(Cat . no . 05619416001) Table 3; プライマー、プローブの配列 Type/subtype Primers and probes Gene fragment A(H1N1)2009 GRswN1‐975 Fw GRswN1‐1084 Rv GRswN1‐1045bProbe(-) NA TCCACGCCCTAATGATAA TTCTCCCTATCCAAACAC Fam 5'‐ATCCTTTTACTCCATTTGCTCC‐3'‐BHQ‐1 A(H3N2)viruses NIID-H3 TMPrimer-F1 NIID-H3 TMPrimer-R1 NIID-H3 Probe1 HA CTATTGGACAATAGTAAAACCGGGRGA GTCATTGGGRATGCTTCCATTTGG 5'‐Fam‐AAGTAACCCCKAGGAGCAATTAG‐MGB-3' Former seasonal A(H1N1) H1h‐1134Fw H1h‐1275Rv H1h‐1206probe NA TGGATGGACAGATACCGACA CTCAACCCAGAAGCAAGGTC 5'‐Fam‐CAGCGGAAGTTTCGTTCAACAT 3'‐BHQ‐1 Influenza type A GRAM/7Fw GRAM/161Rv GRAM probe /52/+ M CTTCTAACCGAGGTCGAAACGTA GGTGACAGGATTGGTCTTGTCTTTA 5'‐Fam‐TCAGGCCCCCTCAAAGCCGAG-3'-BHQ-1 Influenza type B Primer 1 Primer 2 Probe M GAGACACAATTGCCTACCTGCTT TTCTTTCCCACCGAACCAAC 5’FAM-AGAAGATGGAGAAGGCAAAGCAGAACTAGC-3'BHQ‐1 Human internal control GAPDH GAPDH‐6Fw GAPDH GAPDH‐231Rv GAPDH GAPDH‐202Probe(-) GAPDH Oligonucleotide sequence* GAAGGTGAAGGTCGGAGT GAAGATGGTGATGGGATTTC 5'‐Fam‐CAAGCTTCCCGTTCTCAGCC‐3'‐BHQ‐1 *:WHO information for molecular diagnosis of influenza virus in humans – update Nov/2012 に記載の配列を合成 2 ____________________________________________ Figure 1; 増幅曲線【例; A(H1N1)2009】 Figure 2; 検量線【例; A(H1N1)2009】 Figure 3; 増幅曲線【内部コントロール(GAPDH) 】 Table 4; 結果判定表 内部コントロール(GAPDH) 各ウイルス亜型検出系 増幅シグナル(+) 増幅シグナル(−) 増幅シグナル(+) ウイルス遺伝子陽性 ウイルス遺伝子陽性 増幅シグナル(−) ウイルス遺伝子陰性 判定不能 Table 5; 抗原法と PCR 法の比較( A 型) PCR 法( A 型 ) N = 1122 抗原法 (A型) 陽性 陰性 合計 陽性 269 9 278 陰性 17 827 844 合計 286 836 1122 Table 6; 抗原法と PCR 法の比較( B 型) PCR 法( B 型 ) N = 1122 抗原法 (B型) 陽性 陰性 合計 陽性 143 10 153 陰性 31 938 969 合計 174 948 1122 抗原法陽性 /PCR 法陽性 (PCR 法を基準とした場合の抗原法感度) 269 / 286 = 94.1% 抗原法陰性 /PCR 法陰性 (PCR 法を基準とした場合の抗原法特異度) 827 / 836 = 98.9% 抗原法と PCR 法の一致率 1096 / 1122 = 97.7% 抗原法陽性 /PCR 法陽性 (PCR 法を基準とした場合の抗原法感度) 143 / 174 = 82.2% 抗原法陰性 /PCR 法陰性 (PCR 法を基準とした場合の抗原法特異度) 938 / 948 = 98.9% 抗原法と PCR 法の一致率 1081 / 1122 = 96.3% 3 結果 _________________________________________ リアルタイム PCR における結果判定 本法では核酸抽出に約 30 分、その後のリアルタイム PCR を 1.5 ∼ 2.0 時間で実施し、各項目を測定できます。増幅曲線に示すよ うに明瞭な増幅曲線が得られ、かつ Second Derivative Maximum 法で Cp 値が得られた場合を陽性とします (Figure 1)。また、プ ラスミドスタンダードの希釈系列を使用し、検量線を作成すること により、標的遺伝子の半定量測定も可能です (Figure 2)。最終 的な判定はターゲットのウイルス亜型だけでなく、内部コントロール (GAPDH) の増幅曲線から、偽陰性の有無と検体採取がきちんと なされていたかを確認した後に、結果判定を行います (Table 4)。 統計的結果 当院において、2012 年∼ 2014 年 (2 シーズン)にインフルエンザ 様症状を呈した外来および入院患者(1122 例)を対象に、鼻腔 拭い液、咽頭拭い液等を検体として抗原法(クイックナビ TM‐Flu、 デンカ生研を使用)と PCR 法を実施しました。A 型(M gene)に おいて、 PCR 法を基準とした際の抗原法の感度、 特異度、 一致率は、 それぞれ 94.1% (269 / 286)、 98.9% (827 / 836)、 97.7% (1096 / 1122) であり、B 型では、82.2% (143 / 174)、98.9% (938 / 948)、96.3% (1081 / 1122) でした。 抗原法のみでは、A 型で 17 例 (5.9% )、 B 型で 31 例 (17.8% ) の陽性例を陰性と判定したこととなります (Table 5, 6)。 ウイルス変異に対する対応 ウイルス表面タンパクである HA や NA にアミノ酸置換を生じ、抗 原性が変化することにより、A 型インフルエンザが毎年のように流 行しています。当院では 2011 / 2012 シーズンよりA 型インフルエン ザの亜型を測定してきましたが、2012 / 2013 シーズンでは H3N2 流 行株、2013 / 2014 シーズンでは H1N1(2009) 流行株に、それぞ れ連続変異を確認し、その度に流行株に対応したプライマーおよ びプローブを用意し、対応法を構築しました。(上記プライマー、プ ローブと PCR 反応条件は、2013 / 2014 シーズン終了時の流行株 に対応した最新の情報です。) また、今後の遺伝子変異による流行株出現に対応するために、全 ての A 型インフルエンザウイルス亜型に共通で塩基配列が高度に 保存されている遺伝子(M gene)の測定系も加えてあります。従っ て少なくとも A 型か否かの確認が可能となり、これは臨床診断上 有用です。 参考文献 _______________________________________ 1:Nucleic Acids Research, 2003, Vol. 31, No. 22 e143 実施施設 _______________________________________ 独立行政法人国立病院機構新潟病院は、1939 年に傷痍軍人新 潟療養所として発足して以来、国立新潟療養所、国立療養所新 潟病院を経て現病院に至っています。当院の特色は、一般診療 の他に、政策医療として筋ジストロフィー、成育、重症心身障害児 (者) 、神経難病への医療とともに小児慢性疾患地方基幹施設と して発展してきました。また、脳血管障害・小児救急を含む救急 医療、Post-NICU、遺伝カウンセリングへの体制も充実しています。 当院の感染症における遺伝子検査は、紹介したインフルエンザウ 本資料に記載の情報・説明・仕様等は予告なく変更されることがあります。 本記事に記載の弊社製品はライフサイエンス分野の研究のみを目的としています。 イルスの他に、現在、ノロウイルス、マイコプラズマの検査も実 施しています。一般診療の他に、入院・療養中の易感染患者へ の感染防止対策や地域医療の疫学調査としても十分役立ってい ます。 この方法は、第 61 回日本臨床検査医学会学術集会「平成 24・ 25 年度学術推進プロジェクト研究最終報告会」で発表された内容 を引用しております。 ロシュ・ダイアグノスティックス株式会社 〒 105-0014 東京都港区芝 2 丁目 6 番 1 号 TEL. 03-5443-5287 FAX. 03-5443-6654 For life science research only. Not for use in diagnostic procedures. REALTIME READY, LIGHTCYCLER and MAGNA PURE are trademarks of Roche. All other product names and trademarks are the property of their respective holders. 4 © 2014 Roche Diagnostics. All rights re served. 1142.LS.CMS.DATA.LSI02-009A
© Copyright 2026