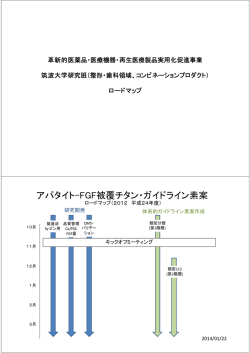
日本での薬事審査業務フローチャート
薬事審査業務フローチャート http://www.pmda.go.jp/operations/shonin/outline.html 審査関連業務の概要 申 請 者 外部専門 医薬品医療機器総合機構(PMDA) 家 面談 申請者 チーム審査 審査・調査専門員 指名・相談 信頼性調査 プレゼン用資料・カタログ・源材質資料・優位性資料 助言 仕様・使用説明書・申請製品の各種データー その他申請製品に関する必要資料 相談手数料:新規医療器・改良医療器・後発医療 クラス別・治験有なし・等相談内容によって異なる 審査報告① 手数料は下記 Web サイトを参照 http://www.pmda.go.jp/operations/shonin/info/ir yokiki/iryokikitaimen.html#2-1 製造所 GMP調査 審査専門協議 審査専門員 外部専門家 問題点の協議・調整・ 面接審査会 審査専門員 主 申請者 外部専門員進 申請者からのプレゼン 要問題点の検討 進行は審査担当部長/総括審査役 審査専門協議Ⅱ 審査専門員 外部専門家 GMP適合性 審査結果通知書 審査報告② 審査結果通知書 諮問 承認 不承認 厚生労働省 答申 薬事・食品衛生 審議会 設計検証 開発前相談 非臨床試験 臨床試験 品質相談 治験相談 承認審査 臨床使用 承認審査 市販後調査 再発癌治療に使用する大掛かり 医療機器臨床治験予算案一例(再発癌治療用大型機器) 区分 外部試験費用 内容 費用(予算案) 物理試験 1,000 万円 生物試験 1,000 万円 動物試験 1,000 万円 安全性試験 1,000 万円 備考 GUP 薬事申請費用 1,000 万円 治験研究費用 9,000 万円 300 万円×10 人×3 疾患 CRO(治験代行業者) 10,000 万円 100 万円×5 人×2 年間 注1対象製品によって治験費用は異なります 2PMDA の相談費用が掛かります 3対象製品のクラスによって費用は異なります
© Copyright 2026