AIO KRK 0207試験:切除不能進行・再発大腸癌患者の一次治療として
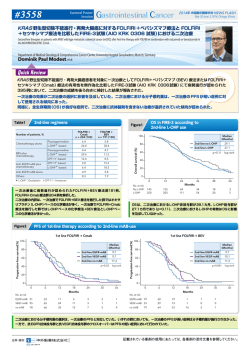
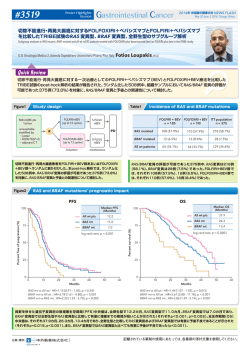
#3503 Oral Abstract Session 2014年 米国臨床腫瘍学会 NEWS FLASH May 30-June 3, 2014, Chicago, Illinois AIO KRK 0207試験:切除不能進行・再発大腸癌患者の一次治療としてフッ化ピリミジン系 薬剤+オキサリプラチン+ベバシズマブ導入療法施行後の維持療法におけるフッ化ピリミジン系 薬剤+ベバシズマブ療法、ベバシズマブ単剤療法あるいは無治療を比較した第Ⅲ相非劣性試験 Maintenance strategy with fluoropyrimidines (FP) plus bevacizumab (Bev), Bev alone, or no treatment, following a standard combination of FP, oxaliplatin (Ox), and Bev as firstline treatment for patients with metastatic colorectal cancer (mCRC) : A non-inferiority phase Ⅲtrial : AIO KRK 0207 Klinik für Tumorbiologie, Freiburg, Germany Dirk Arnold, et al. 切除不能進行・再発大腸癌に対するオキサリプラチン(L-OHP)を含む化学療法+ベバシズマブ(BEV)療法施行後の、維持療 法におけるフッ化ピリミジン系薬剤単剤(FP)+ BEV 療法に対する BEV 単独療法あるいは無治療の非劣性について検証した 結果が報告された。 主要評価項目である TFS は、FP + BEV 療法群に対する BEV 単独療法群の非劣性は認められたが、FP + BEV 療法群に対 する無治療群の非劣性は認められなかった。PFS1 は、FP + BEV 療法群で 6.2 カ月、BEV 単独療法群で 4.8 カ月、無治 療群で 3.6 カ月であった。PFS1 の結果から、維持療法においてはコントロールアームである FP+BEV 療法が標準治療で あることが示唆された。 Treatment algorithms FP*+ BEV+ Oxaliplatin FP* + BEV R BEV with CR/PR/ SD no treatment Stratification ・Adjuvant tx ・CR/PR vs SD ・ECOG PS ・CEA at baseline Re-Induction any FP* +/- BEV +/- Ox 2nd progression Maintenance: non-PD 1st progression Induction: 24 wks PFS1 TFS 切除不能進行・再発大腸癌患者に対して導入療法としてFOLFOX/CapeOX +BEV を24 週 間 投 与し、PDとならな かった 患 者 をFP+BEV 療 法 群、 BEV 単独療法群、あるいは無治療群へランダムに割り付けた。 主要評価項目は time to failure of strategy(TFS;ランダム化から維持療 法および再導入療法後のPDまでの期間) 、副次的評価項目は無増悪生存期間 (PFS1;ランダム化から初回PDまでの期間) 、 全生存期間 (OS) 、 毒性等とした。 再導入を施行せず二次療法もしくは治療非施行例ではPFS1を TFSとした。 片側α=0.00125、検出力 80%、非劣性マージン上限をHR=1.43として サンプルサイズを算出したところ、必要イベント数は各群148 イベントで あった。 AIO sponsored phase Ⅲ trial 106 sites in Germany (55 hospital, 51 private practices) 837 eligible 8 major protocol violations 829 started induction n = 353(42%) not randomized 476 randomized 3 major protocol violations 156 BEVmono BEV n = 156 no treatment n = 158 84 79 82 86 Capecitabine 16 21 18 14 CR/PR 44 60 60 59 SD 28 40 40 41 PD 16 - - - NE/ND 11 - - - 16/84 16/84 16/84 16/84 Age (median, range); yrs. 64 (25-82) 65 (32-82) 66 (32-82) Gender (female/male); % 33/67 32/68 37/63 64/32/3 63/34/3 59/38/3 Site (colon/rectum); % 65/35 61/39 63/37 No. of metastatic sites (1/>1); % 47/52 45/55 39/61 LDH (normal/abnormal/nr * ); % 46/44/10 38/51/11 35/57/8 Discont. of Ox yes / no at induction (%) ECOG PS (0/1/2); % Primary tumor resected; % 75 77 70 Previous (neo) adjuvant chemo; % 12 12 10 M1 at diagnosis 79 79 79 4 8 9 unknown; % * not reported 患者背景は、3 群において概ね差は認められなかった。 TFS: All arms 100 n 80 Median Events (months) 115 6.8 FP/BEV 141 BEV 153 129 6.5 No treatment 153 138 6.1 All patients from randomization 60 6.5 log-rank test p=0.099 40 20 0 473 randomized and eligible 159 FP/BEV Randomized pts FP/BEV n = 159 FU/FA Induction FP backbone (%) Figure3 Study conduct 852 assessed for eligibility All pts n = 852 Best response (%) *FP = any fluoropyrimidine in a standard protocol (e.g. mFOLFOX6, FOLFOX4, Cape/Ox, LV5FU2, Cape 2x1000) BEV used in standard doses (5 mg/kg q 2 wks or 7.5 mg/kg q 3wks arm A; 7.5 mg/ kg 3q 3 wks arm B) Figure2 Baseline characteristics Table1 Rate without event (%) Figure1 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 Time (months) 158 no treatment BEV vs FP/BEV HR=0.98; 95%CI: 0.76-1.26、 log-rank test p=0.85 no treatment vs FP/BEV HR=1.22, 95%CI: 0.96-1.57、 log-rank test p=0.11 852 例を登録し、うち 476 例をFP+BEV 療法群(159 例) 、BEV 単独療 法群(156 例)あるいは無治療群(158 例)へランダムに割り付けた。 主要評価項目であるTFSは、FP+BEV 療法群で6.8カ月、BEV 単独療法群 で6.5カ月、無治療群では6.1カ月であった(p=0.099) 。 本報告には、日本では未承認・適応外の薬剤および用法・用量が含まれておりますのでご注意ください。 記載されている薬剤の使用にあたっては、各薬剤の添付文書を参照してください。 #3503 Oral Abstract Session 2014年 米国臨床腫瘍学会 NEWS FLASH May 30-June 3, 2014, Chicago, Illinois AIO KRK 0207 試験:切除不能進行・再発大腸癌患者の一次治療としてフッ化ピリミジン系薬剤+オキサリプラチン+ベバシズマブ 導入療法施行後の維持療法におけるフッ化ピリミジン系薬剤+ベバシズマブ療法、ベバシズマブ単剤療法あるいは無治療を比較した 第Ⅲ相非劣性試験 PFS1 from start of maintenance Figure4 Rate without event (%) 100 80 n Events Median (months) FP/BEV 141 116 6.2 BEV 153 135 4.8 No treatment 153 145 3.6 All patients from randomization Months Median TFS Median PFS1 6 4.6 4 log-rank test p<0.001 60 Re-induction rates and PFS1/TFS Figure5 2 40 20 0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 Time (months) BEV vs FP/BEV HR=1.21; 95%CI: 0.95-1.58、 log-rank test p=0.13 no treatment vs FP/BEV HR=2.08, 95%CI: 1.80-2.66、 log-rank test p<0.001 no treatment vs BEV HR=1.57, 95%CI: 1.24-1.98、 log-rank test p<0.001 PFS1中央値は、FP+BEV 療法群で 6.2 カ月、BEV 単独療法群で 4.8 カ月、 無治療群では 3.6 カ月であった。FP+BEV 療法群はBEV 単独療法群と比 較して良好な成績であり(HR=1.21、95%CI:0.95-1.56、p=0.13) 、無 治療群と比較して有意な差が認められた(HR=2.06、95% CI:1.60-2.66、 p <0.001) 。 100 FP/BEV n = 146 BEV n = 147 no treatment n = 155 Progressive disease 58% 79% 86% Unacceptable toxicity 8% 5% 1% Investigator's decision 7% n Events Median (months) FP/BEV 157 70 23.8 BEV 156 67 26.2 No treatment 156 66 23.1 All patients from randomization 80 23.7 log-rank test p=0.70 60 40 20 0 20% FP/BEV OS from start of maintenance Figure6 End of maintenance: Main reasons Patient demand BEV 維持療法後の再導入率は、FP+BEV 療法群で 21%、BEV 単独療法群で 43%、無治療群では 45%であった。 Rate without event (%) Table2 No treatment Re-induction No re-induction 21% 43% 45% 0 5 10 15 7% 20 25 30 35 40 45 Time (months) n=473 Interim analysis: 203 events 5% 4% 4% 維持療法開始以降の OS 中央値は、FP+BEV 療法群で 23.8 カ月、BEV 単 独療法群で 26.2 カ月、無治療群では 23.1カ月であった(p=0.70) 。 維持療法の主な中止の理由はPD であり、許容できない有害事象はFP+ BEV 療法群で 8%、BEV 単独療法群で 5%、無治療群では1%であった。 末梢神経障害はいずれの群においても概ね Grade1∼ 2 であり、その他の Grade3 の毒性はいずれも5%未満であった。 本報告には、日本では未承認・適応外の薬剤および用法・用量が含まれておりますのでご注意ください。 記載されている薬剤の使用にあたっては、各薬剤の添付文書を参照してください。
© Copyright 2026