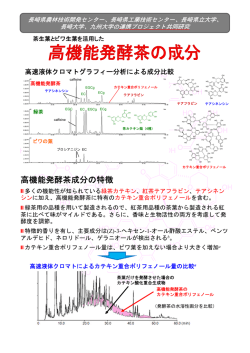
Kobayashi-1096-1
カテキンのコレステロール吸収抑制機構に 関する研究 小林 誠 カテキンのコレステロール吸収抑制機構に関する研究 ─目次─ 第 1 章:序論 第2章 第1節 1 胆汁酸ミセルおよびリン脂質ベシクルへのカテキン添加の影響 コレステロールおよびリン脂質の胆汁酸ミセル溶解性に及ぼす カテキン添加の影響 14 第2節 リン脂質ベシクルに及ぼすカテキン添加の影響 27 第3節 ホスファチジルコリンのコレステロールのミセル溶解性への影響 31 第4節 コレステロールおよびホスファチジルコリンの胆汁酸ミセルへの 親和性に及ぼすエピガロカテキンガレート添加の影響 第3章 第1節 カテキンと胆汁酸ミセルとの相互作用解析 1 H-NMR (1H-nuclear magnetic resonance) によるカテキンと胆汁酸 ミセルとの相互作用解析 第2節 34 46 DOSY (diffusion ordered spectroscopy) 法による エピガロカテキンガレートと胆汁酸ミセルとの相互作用解析 58 第3節 1 65 第4節 エピガロカテキンガレートの胆汁酸ミセル中での局在位置の解析 第5節 エピガロカテキンガレートと胆汁酸ミセルとの H 縦緩和時間測定によるカテキンと胆汁酸ミセルとの相互作用解 NOE (nuclear Overhauser effect) 解析 70 75 第4章 表面プラズモン共鳴法を用いた分子間相互作用解析 第1節 各種カテキンとホスファチジルコリンの分子間相互作用解析 89 第2節 エピガロカテキンガレートとコレステロールの分子間相互作用解析 99 第5章 第1節 カテキンのコレステロール吸収抑制作用 Caco-2 細胞へのコレステロール取り込みに及ぼす エピガロカテキンガレートの影響 第2節 膵胆管カニュレーション手術を施したラットにおけるミセル コレステロール吸収に及ぼすエピガロカテキンガレートの影響 第6章 114 総括 127 139 参考文献 147 謝辞 159 第 1 章:序論 茶は、ツバキ科に属する常緑の灌木であるチャ(Camellia sinensis)の葉を加 工して供され世界で最も飲用されている嗜好飲料のひとつとなっている。茶は 茶葉の発酵度の違いにより緑茶、烏龍茶、紅茶に大別される。一般的に、緑茶 の加工の際、茶葉の摘栽後に茶葉中のポリフェノールオキシダーゼを不活化さ せるために蒸熱処理あるいは釜炒り処理が行われる。この処理によって緑茶ポ リフェノールの酸化重合を抑える。烏龍茶および紅茶の加工は緑茶ポリフェノ ールをある程度および完全に酸化重合させることで行われる 1) 。緑茶の主要な ポリフェノールはカテキン類であり主に、(─)-エピカテキン(EC)、(─)-エピカテ キンガレート(ECG)、(─)-エピガロカテキン(EGC)、および(─)-エピガロカテキン ガレート(EGCG)の 4 種が含有されている (Fig. 1)。その中で EGCG の含量が最 も高い。緑茶のカテキン含有量は、茶の品種、茶葉の摘採時期や製茶方法によ って異なるが、乾燥重量あたりおよそ 10-18 % である 2, 3) 。カテキン類はガロ イル基の有無により遊離型カテキン(EC および EGC)、ガレート型カテキン (ECG および EGCG)に大別される。緑茶抽出液中のカテキンのうち、ガレー ト型カテキンが約 50~60 %、遊離型カテキンが約 30~40 % 程度である。1981 年に缶入り茶飲料が発売されて以降、緑茶の缶及びペットボトル飲料の生産量 は年々増加している。これらの容器詰飲料中の茶カテキンは加熱殺菌時に、そ の約 50 % が C 環の 2 位に熱異性化を受け、熱異性化カテキンを生じ、EC、EGC、 ECG および EGCG からそれぞれ、(─)-カテキン(C)、(─)-ガロカテキン (GC)、(─)カテキンガレート(CG)および(─)-ガロカテキンガレート(GCG) が生成される 4, 5, 6) (Fig. 1)。容器詰緑茶飲料にはこれらの 8 種のカテキンが含有されており、 容器詰緑茶飲料の摂取量増加にともなって、我々日本人の熱異性化カテキンの 摂取量も年々増加している。 1 緑茶カテキンはアテローム生成抑制効果 7)、抗肥満効果 8-10)、抗酸化作用 11, 12)、 抗腫瘍形成抑制効果 13, 14)、高トリアシルグリセロール血症抑制効果 15, 16)等、様々 な健康機能性について研究されてきている。血清コレステロール低下作用につ いても疫学研究 17-20)、ヒト介入試験 21, 22)、メタアナリシス 23, 24)、実験動物 16, 25-31) を用いた試験で多数報告されている。高コレステロール血症は冠動脈性心疾患 の重要なリスクファクターのひとつである 32, 33)。血漿コレステロール、特に LDLコレステロールの上昇はアテローム性動脈硬化巣の発展を導き得る 34)。 緑茶摂取と血清コレステロール濃度の関連性については、5 つの疫学研究が報 告されている 17-20, 35)。Imai らは、1,330 名の 40 歳以上の日本人男性を緑茶摂取 量が一日 3 杯以下、4-9 杯、10 杯以上の 3 群に分けると、緑茶摂取量の増加に伴 う血清総コレステロール濃度、LDL-コレステロール濃度および VLDL-コレステ ロール濃度の低下を報告した 17)。Kono らは 1,306 名の男性での横断的疫学研究 にて、一日に緑茶を 9 杯以上摂取するヒトの血清総コレステロール濃度は、一 日に緑茶を 2 杯以下摂取するヒトのそれよりも 8 mg/dl 低いことを報告した 18)。 Kono らはまた、2,062 名の男性(49-55 歳)での疫学研究において、一日に緑 茶を 10 杯摂取するヒトの血清総および LDL-コレステロール濃度は、緑茶を摂 取しないヒトよりもそれぞれ 7.3 mg/dl、7.2 mg/dl 低いことを報告した 19)。 Tokunaga らは、13,916 名の日本人労働者(男性 8,476 名、女性 5,440 名)を解 析した結果、緑茶摂取は血清総コレステロール濃度の低下と関連があることを 示し、また、一日に緑茶を 10 杯以上摂取してもさらなる血清総コレステロール 濃度の低下がみられないことを報告した 20)。一方で、Tsubono らによる、630 名 の中年男性とその配偶者 370 名での横断的疫学研究では、緑茶摂取量が一日 1 杯以下、1-4 杯、4 杯以上の 3 群に分けた場合、緑茶の血清総コレステロール濃 度に対する有益な効果は認められなかったことが報告されている 35)。これらの 2 疫学研究の結果は一日 10 杯以上の緑茶摂取、 (480 mg 以上のカテキン類の摂取) が血清総コレステロール濃度を低下させるのに有効であることを示唆する。 緑茶カテキンの摂取が血清コレステロール濃度低下作用を有するかどうか については、いくつかのヒト介入試験が行われている。Kajimoto らは、境界域 高コレステロール血症被検者においてガレート型カテキン飲料 3 ヶ月間摂取の 血清コレステロール濃度に及ぼす影響を検討するため、並行群間二重盲検試験 を行った 21)。血清総コレステロール値 180-260 mg/dl の 20 歳以上の成人男女 60 名に、12 週間のガレート型カテキン配合飲料摂取試験を実施した。試験は被験 者を「プラセボ飲料」群と「試験飲料」群の 30 名ずつに分けた。「プラセボ飲 料」は、茶カテキンを除いた緑茶抽出液 250ml で、これに 197 mg のガレート型 カテキンを配合したものを「試験飲料」とした。この飲料 250 ml を朝食時およ び夕食時に1本ずつ、つまり一日 2 本を 12 週間摂取させ、試験開始前と試験開 始以降、4 週間ごとに採血を行った。摂取開始 2 ヶ月および 3 ヶ月目に、試験飲 料群で摂取開始前と比較して血清総コレステロール濃度が有意に低下した。ま た、摂取開始 3 ヶ月目には、プラセボ群と比較して有意に低下した。LDL-コレ ステロール濃度も、摂取開始 2 ヶ月および 3 ヶ月目に、試験飲料群で摂取開始 前と比較して有意に低下したこと、HDL-コレステロール濃度の低下が認められ なかったことから、この総コレステロール濃度の低下は、主に LDL-コレステロ ール濃度の低下によるものと推察された。さらに、Kajimoto らは、血清総コレ ステロール値 180-260 mg/dl の 20 歳以上の閉経前の女性 123 名に、12 週間のガ レート型カテキン配合飲料摂取試験を実施した 22)。一般に女性では月経周期に より変動するエストロゲンの脂質代謝に対する影響により、特に血清コレステ ロール濃度が変動しやすく、女性のみを対象とした試験は極めて少ない。試験 は被験者を「プラセボ飲料」群(n = 67)と「試験飲料」群(n = 65)に分けた。 3 「プラセボ飲料」は、茶カテキンを除いた緑茶抽出液 250ml で、これに 196.2 mg のガレート型カテキンを配合したものを「試験飲料」とした。この飲料 250ml を朝食時および夕食時に1本ずつ、つまり一日 2 本を 12 週間摂取させ、試験開 始前と試験開始以降、4 週間ごとに採血を行った。総コレステロール濃度および LDL-コレステロール濃度が、摂取開始 4, 8, 12 週間目に、試験飲料群で摂取開 始前と比較して有意に低下した。なお、この 2 つのヒト介入試験は、試験飲料 の殺菌処理を伴うため、ガレート型カテキンの約 50 % は熱異性化を受けている 21, 22) 。 近年、緑茶飲料あるいは緑茶カテキン摂取と血清総コレステロールおよび LDL-コレステロール濃度の関連について 2 つのメタアナリシス結果が報告され た。メタアナリシスでは、過去に独立して行われた複数の臨床研究のデータを 収集、統合し、統計的方法を用いて解析する。Zheng らは、緑茶飲料として 36-40)、 あるいは緑茶抽出物として 40-49)、 緑茶カテキン 150-2500 mg/day を 3 週間~3 ヶ 月摂取させた 14 のランダム化コントロール試験、計 1136 名でメタアナリシス を行った 23)。その結果、緑茶カテキンを含有する緑茶飲料および緑茶抽出物の 摂取は、血清総コレステロールおよび LDL-コレステロール濃度を有意に低下さ せると結論づけた。また、Kim らは、緑茶カテキン 145-3000 mg/day を 3~24 週間摂取させた、20 のランダム化コントロール試験 38-44, 46-58) 、計 1415 名でメ タアナリシスを行った 24)。その結果から、これらの緑茶カテキンの摂取は、血 清総コレステロールおよび LDL-コレステロール濃度を有意に低下させると結論 づけた。これらのことから、緑茶カテキンの適正な摂取は、血清コレステロー ル濃度低下作用を発揮し、高コレステロール血症に有効であると考えられる。 日本では、緑茶カテキン、特にガレート型カテキンの血清コレステロール低下 作用を期待した、ガレート型カテキン配合の緑茶飲料(特定保健用食品)も発 4 売されている。高コレステロール血症は動脈硬化性心血管疾患の最大のリスク ファクターであることから、ガレート型カテキンの適正な摂取は、動脈硬化性 心血管疾患の予防の一助となることが期待される。緑茶摂取量が多いヒトほど 心臓血管系疾患による死亡率が低下するという報告がなされている 60)。この死 亡率の低下には、緑茶カテキンのコレステロール吸収抑制作用も一部寄与して いると考えられる。 これら緑茶カテキンの血清コレステロール濃度低下作用は多くの動物試験で も報告されている。1986 年に Muramatsu らは、1 % コレステロール食を 28 日 間摂食させたラットを用いた試験にて緑茶カテキン抽出物を 1 および 2 % 添加 しておくと血清コレステロール濃度が低下することを報告した 61)。緑茶カテキ ン抽出物を摂取させると、糞便中のコレステロール排泄量が増加していたこと から、緑茶カテキンは小腸でのコレステロールの吸収を阻害すると考えられた。 Fukuyo らは、緑茶抽出物から精製した EGCG でも同様に血清コレステロール 濃度を低下させること、糞便中のコレステロール排泄量を増加させることを報 告した 62)。また、Matsuda らは、茶葉のメタノール抽出物(EGCG および ECG を含む)を 2.5 % コレステロール食を摂食させたマウスに経口投与すると、血 清コレステロール濃度が低下することを報告した 63)。さらに、Chan らによって、 ジャスミン茶抽出物(EGCG, ECG, EGC, および EC を含む)の 2 週間の摂取に より食餌コレステロールにより鋭敏に血清コレステロール濃度が上昇するハム スターでも同様に血清コレステロール濃度が低下させること、糞便中のコレス テロール由来中性ステロイド排泄量を増加させることを報告した 64)。また、Bose らは、これらの報告よりも低濃度の EGCG 添加でも、高脂肪食を 16 週間と長期 間摂食させたマウスにおいて血清コレステロール濃度の上昇を抑制させること を報告した 65)。これらの報告では食餌にコレステロールを添加しているが、 5 Nakamura らによって、特に食事にコレステロールを負荷しなくても EGCG に 富んだ緑茶抽出物を 1.0g/kg、23 日間ラットに経口投与すると、糞便中のコレス テロール由来中性ステロイド排泄量を増加させることが報告された 66)。 このこ とは、カテキンを含む緑茶抽出物が外因性だけでなく内因性のコレステロール 吸収を抑制することを示唆する。一方で、Yang らは、Lung Chen Tea 抽出物(中 国緑茶のひとつで EGCG に富む)を食餌誘発性高コレステロール血症ラットに 8 週間与えたところ、血清および肝臓コレステロール濃度を低下させることを報 告した 67)。その際、Lung Chen Tea 抽出物は肝臓でのコレステロール合成の律速 酵素である 3-hydroxy-3-methylglutaryl-coenzyme A reductase 活性に影響を与えな かったことも報告した。これらのことから、緑茶カテキンはコレステロール吸 収を抑制することで血清コレステロール濃度低下作用を発揮することが示唆さ れた。 緑茶カテキンの小腸でのコレステロール吸収抑制作用についても多くの研究 がなされてきた。Chisaka らは、in situ で空腸上部に注入した胆汁酸ミセルに溶 解したコレステロールの小腸上皮細胞への取り込みが、胆汁酸ミセルに EGCG を添加することで低下することを報告した 68)。さらに彼らは、二重標識比法を 用いてコレステロール吸収率の検討を行い、EGCG 摂取によりコレステロール 吸収が低下することを示した。Ikeda らは、緑茶カテキンのコレステロール吸収 抑制作用を直接的に調べるため、胸管リンパカニュレーション手術を施したラ ットを用いて試験を行った 26)。彼らはガレート型カテキンの多いもの、遊離型 カテキンの多いもの 2 種類の緑茶抽出物どちらの投与も放射性コレステロール 吸収を抑制することを報告した。また、特にガレート型カテキンの多い緑茶抽 出物は、遊離型カテキンの多い緑茶抽出物よりも強く放射性コレステロール吸 収を抑制することを報告した。これらのことから、緑茶カテキンは小腸でのコ 6 レステロール吸収を抑制し、その作用はガレート型カテキンで強いことが直接 的に示された。さらに Ikeda らは、緑茶カテキンのコレステロール吸収抑制作 用機構について人工胆汁酸ミセルを用いて検討を行った 26)。消化管に流入した コレステロールは、胆汁に含まれる胆汁酸やリン脂質および中性脂肪加水分解 物である脂肪酸やモノアシルグリセロールとともに胆汁酸ミセルを形成し、溶 解する。この胆汁酸ミセルへの溶解がコレステロール吸収の必須条件と考えら れている。彼らは、コレステロール、リン脂質としてホスファチジルコリンお よび胆汁酸としてタウロコール酸ナトリウムを含む人工胆汁酸ミセルを超音波 処理により作成し、緑茶カテキン抽出物や各種カテキンの純品をこの胆汁酸ミ セルに添加することで影響を調べた。胆汁酸ミセルに緑茶カテキン抽出物や各 種カテキンの純品を添加すると直ちに濁り、沈殿を生じた。そこで、上清を回 収し、コレステロールおよびタウロコール酸の濃度を測定したところ、コレス テロール濃度は緑茶カテキン抽出物添加量依存的に低下し、その作用はガレー ト型カテキンの多い緑茶抽出物で強く、遊離型カテキンの多い緑茶抽出物では 弱いことを示した。一方、胆汁酸濃度は緑茶抽出物の影響は受けないことも報 告した。また、高純度カテキン(EGCG, ECG, EGC, EC)を用いて同様に検討し たところ、EGCG が最もコレステロール低下作用が強く、次に ECG が強いこ と、遊離型カテキンである EGC および EC はコレステロール低下作用が弱いこ とを示した 26)。さらに、EGCG を用いて、胆汁酸ミセル中のコレステロール濃 度と EGCG 濃度の関係を調べ、EGCG 添加量依存的にコレステロールおよび EGCG の沈殿量が平行して増加することを報告した。これらの結果から、緑茶 カテキン、特にガレート型カテキンが胆汁酸ミセル中のコレステロールと結合 沈殿し、胆汁酸ミセルのコレステロール量を減少させることが示唆された。こ の作用によってコレステロール吸収が抑制され、糞便へのコレステロール排泄 7 量が増加すると考えられた。 1981 年に缶入り茶飲料が発売されて以降、緑茶の缶及びペットボトル飲料の 生産量は年々増加している。これらの容器詰飲料中の茶カテキンは加熱殺菌時 に、その約 50 % が熱異性化を受け、熱異性化カテキンを生じる 4, 5, 6)。よって、 容器詰緑茶飲料の摂取量増加にともなって、我々日本人の熱異性化カテキンの 摂取量も年々増加している。しかしながら、前述の研究の多くでは熱異性化カ テキンの機能性に注目した検討は行われてこなかった。我々は、通常のガレー ト型カテキン混合物とこれに熱処理をすることで作成した熱異性化ガレート型 カテキン混合物の血清コレステロール濃度低下作用をラットで比較した 30)。ガ レート型カテキン混合物および熱処理ガレート型カテキン混合物はラットの血 清、肝臓コレステロール濃度を同程度低下させることを示した。また、どちら のガレート型カテキンも糞便へのコレステロール由来中性ステロイド排泄量を 増加させた。熱処理によるコレステロール吸収抑制作用への影響は認められな かった。Ikeda らは、通常のガレート型カテキン混合物と熱異性化ガレート型カ テキン混合物のコレステロール吸収抑制作用を直接的に比較するため、胸管リ ンパカニュレーション手術を施したラットを用いて試験を行った 27)。ガレート 型カテキン混合物および熱処理ガレート型カテキン混合物は胸管リンパへのコ レステロール吸収を抑制した。その抑制作用は熱処理ガレート型カテキンのほ うがガレート型カテキンよりも強かった。このコレステロール吸収抑制作用に よって、上述の摂食試験 30)においてどちらのガレート型カテキンも糞便へのコ レステロール排泄を増加させ、ラットの血清、肝臓コレステロール濃度を低下 させたと考えられた。さらに Ikeda らは、胆汁酸、ホスファチジルコリン(PC) およびコレステロール含有胆汁酸ミセルに高純度カテキン(EGCG, ECG, EGC, EC, GCG, CG, GC, C)を添加して、ミセルに残存するコレステロールおよび胆汁 8 酸濃度を測定した。ミセル内残存コレステロール濃度はガレート型カテキン添 加量依存的に減少した。さらに、熱処理によって生じる GCG および CG は、そ れぞれの由来である EGCG および ECG よりも強い低下作用を示した。このこ とが、GCG および CG 含量の増えた熱処理ガレート型カテキン混合物が、通常 のガレート型カテキン混合物よりもコレステロールのリンパ吸収抑制作用が強 い要因と考えられた。一方、どの遊離型カテキンもミセル内残存コレステロー ル濃度に影響を与えなかった。一方で、どのカテキンも胆汁酸濃度に影響は与 えておらず、胆汁酸排泄を亢進して体内コレステロールプールサイズを減少さ せるとは考えられなかった。これらの結果から、若干の効果の強弱はあるもの の、熱異性化ガレート型カテキンも通常のガレート型カテキンと同様に、胆汁 酸ミセルのコレステロール量を減少させることでコレステロール吸収を抑制し、 糞便へのコレステロール排泄量を増加させると考えられた。ヒト介入試験にお いても、ガレート型カテキンの約 50 % が熱異性化を受けている試験飲料で血清 コレステロール濃度低下作用が報告されている 21, 22)。 その後、緑茶カテキンを含めて他のポリフェノールについても胆汁酸ミセル へのコレステロール溶解性への影響について追試が行われてきた。Raederstorff らは、高純度 EGCG がコレステロールの胆汁酸ミセル溶解性を低下させること を確認し、さらに、胆汁酸ミセルに高純度 EGCG を添加すると、胆汁酸ミセル の粒子径が大きくなることを示した 31)。Vermeer らは、緑茶抽出物が胆汁酸ミ セルへのコレステロールの取り込みを阻害することを報告した 69)。但し、一度 ミセルに取り込まれたコレステロールが除去された可能性も考えられた。さら に、紅茶に含まれるテアフラビン類が緑茶抽出物と同様に胆汁酸ミセルへのコ レステロールの取り込みを阻害するものの脂肪酸や胆汁酸の取り込みには影響 を与えないと報告した 69)。 9 しかしながら、どのようにしてガレート型カテキンが胆汁酸ミセル中のコレ ステロール沈殿させるのかはいまだ明らかにされていない。Kajiya らは、ガレ ート型カテキンがその分子内に疎水性領域を持つ一方、遊離型カテキンの分子 内には疎水性領域がないことを報告した 70)。コレステロールは疎水性分子のた め、ガレート型カテキン分子内の疎水性領域と疎水性相互作用する可能性が考 えられる。また、彼らはガレート型カテキンが遊離型カテキンよりもリン脂質 二重層と高い親和性を持つことを示した 70)。同じ研究グループの Kumazawa ら は、EGCG 分子がリン脂質二重層と相互作用することを、31P および 2H を用い た固体核磁気共鳴法(固体 NMR)にて証明した 71)。さらに同じ研究グループの Uekusa らは、ガレート型カテキンである EGCG および ECG が、脂質膜表面で PC のトリメチルアンモニウム基を介して相互作用(cation-相互作用)するこ とを、溶液 NMR 法を用いて示した 72)。さらに Uekusa らは、EGCG および ECG がその分子内にて B 環およびガロイル基平面が-相互作用によってスタッキ ング構造をとること、この-相互作用が EGCG および ECG と PC との cation- 相互作用を増強する可能性を示した 73)。これらのことから、ガレート型カテキ ンのガロイル基と PC との相互作用が、Chol の沈殿と何らかの関係があると考 えられるが、この点に関する情報はない。そこで、ガレート型カテキンの胆汁 酸ミセルのコレステロール溶解性低下作用機構を解明するため研究を実施した。 10 OH HO OH A C OH OH B O OH OH HO O OH O O OH O OH OH O OH OH OH OH (─)-Epigallocatechin gallate (EGCG) (─)-Gallocatechin gallate (GCG) OH OH OH HO O OH HO O O OH O OH O OH OH O OH OH OH OH (─)-Epicatechin gallate (ECG) (─)-Catechin gallate (CG) OH OH OH HO O OH OH HO O OH OH OH OH OH (─)-Epigallocatechin (EGC) (─)-Gallocatechin (GC) OH OH OH HO O OH HO O OH OH OH OH (─)-Epicatechin (EC) (─)-Catechin (C) Fig. 1 緑茶カテキンの化学構造 左列: 緑茶カテキン, 右列: 熱異性化カテキン 11 なお、本論文では以下の略号を使用した。 BSA, bovine serum albmin C, (─)-catechin CG, (─)-catechin gallate DOPA, 1,2-dioleoylphosphatidic acid DOSY, diffusion ordered spectroscopy DSS, sodium 2,2-silapentane-5-sulfonate EC, (─)-epicatechin ECG, (─)-epicatechin gallate EGC, (─)-epigallocatechin EGCG, (─)-epigallocatechin gallate GC, (─)-gallocatechin GCG, (─)-gallocatechin gallate MO: 1-monooleoylglycerol NOE, nuclear Overhauser effect NOESY, NOE-correlated spectroscopy NMR, nuclear magnetic resonance OA: oleic acid PA, phosphatidic acid PC, phosphatidylcholine PE, phosphatidylethanolamine PI, phosphatidylinositol POPC, 1-palmitoyl-2-oleoylphosphatidylcholine PS, phosphatidylserine 12 RU, resonance unit 2-SA, 2-(9-anthroyloxy) stearic acid 12SA, 12-(9-anthroyloxy) stearic acid SPR, surface plasmon resonance T1, 1H 縦緩和時間 13 第2章 胆汁酸ミセルおよびリン脂質ベシクルへのカテキン添加の影響 第1節 コレステロールおよびリン脂質の胆汁酸ミセル溶解性に 及ぼすカテキン添加の影響 消化管に流入したコレステロールは、胆汁に含まれる胆汁酸やリン脂質およ び中性脂肪加水分解物である脂肪酸やモノアシルグリセロールとともに胆汁酸 ミセルを形成し、溶解する。この胆汁酸ミセルへの溶解がコレステロール吸収 の必須条件と考えられている。Ikeda らは、コレステロール、リン脂質としてホ スファチジルコリンおよび胆汁酸としてタウロコール酸ナトリウムを含む人工 胆汁酸ミセルに緑茶カテキン抽出物や各種カテキンの純品を添加するとミセル コレステロール濃度が緑茶カテキン抽出物添加量依存的に低下することを示し た 26)。また、その作用はガレート型カテキンの多い緑茶抽出物で強く、遊離型 カテキンの多い緑茶抽出物では弱いことを示した。一方、胆汁酸濃度は緑茶抽 出物の影響は受けないことも報告した。また、4 種類の高純度カテキン(EGCG, ECG, EGC, EC)を用いて同様に検討したところ、EGCG が最もコレステロール 低下作用が強く、次に ECG が強いこと、遊離型カテキンである EGC および EC はコレステロール低下作用が弱いことを示した。EGCG を用いて、胆汁酸ミセ ル中のコレステロール濃度と EGCG 濃度の関係を調べたところ、EGCG 添加量 依存的にコレステロールおよび EGCG の沈殿量が平行して増加することを示し た。さらに、Ikeda らは、胆汁酸ミセルに 8 種類の高純度カテキン(EGCG, ECG, EGC, EC, GCG, CG, GC, C)を添加して、残存するコレステロールおよび胆汁酸 濃度を測定した 27)。ミセル内残存コレステロール濃度はガレート型カテキン添 加量依存的に減少した。熱処理によって生じる GCG および CG は、それぞれの 由来である EGCG および ECG よりも強い低下作用を示した。これらの結果か 14 ら、緑茶カテキン、特にガレート型カテキンが胆汁酸ミセル中のコレステロー ルと結合沈殿し、胆汁酸ミセルのコレステロール量を減少させることが示唆さ れた。しかしながら、どのようにしてガレート型カテキンが胆汁酸ミセル中の コレステロールを沈殿させるのかはいまだ明らかにされていない。Kajiya らは、 ガレート型カテキンがその分子内に疎水性領域を持つ一方、遊離型カテキンの 分子内には疎水性領域がないことを報告した 70)。コレステロールは疎水性分子 のため、ガレート型カテキン分子内の疎水性領域と疎水性相互作用する可能性 が考えられる。また、彼らはガレート型カテキンが遊離型カテキンよりもリン 脂質二重層と高い親和性を持つことを示した 70)。同じ研究グループの Kumazawa らは、EGCG 分子がリン脂質二重層と相互作用することを、31P および 2H を用 いた固体核磁気共鳴法(固体 NMR)にて証明した 71)。同じ研究グループの Uekusa らは、ガレート型カテキンである EGCG および ECG が、脂質膜表面でホスフ ァチジルコリンのトリメチルアンモニウム基を介して相互作用(cation-相互作 用)することを、溶液 NMR 法を用いて示した 72)。さらに Uekusa らは、EGCG および ECG がその分子内にて B 環およびガロイル基平面が-相互作用によっ てスタッキング構造をとること、この-相互作用が EGCG および ECG とホス ファチジルコリンとの cation-相互作用を増強する可能性を示した 73)。これら のことから、ガレート型カテキンのガロイル基とホスファチジルコリンとの相 互作用が、胆汁酸ミセルからのコレステロールの沈殿を引き起こす可能性が考 えられた。そこで、まずはコレステロールだけでなくリン脂質の胆汁酸ミセル 溶解性に及ぼすカテキン添加の影響を検討した。 試薬 実験に用いた試薬は以下の会社から購入した。 15 「Sigma-Ardrich」 コレステロール、5-コレスタン、ホスファチジルコリン(PC、卵黄由来)、ホ スファチジン酸(PA、卵黄由来) 、スファチジルエタノールアミン(PE、卵黄由 来)、ホスファチジルイノシトール(PI、大豆由来)、ホスファチジルセリン(PS、 大豆由来)、ペンタデカン酸、1-モノオレオイルグリセロール(MO)、オレイン 酸(OA) 「ナカライテスク」 タウロコール酸ナトリウム、リン酸二水素ナトリウム二水和物、1,1,1,3,3,3-ヘキ サメチルジシラザン、トリメチルクロロシラン、水酸化カリウム 「和光純薬工業」 EGCG、GCG、EGC、塩化ナトリウム、ピリジン(脱水)、メタノール、エタ ノール、ヘキサン、クロロホルム 「同仁化学」 ジエチルエーテル 方法 実験 2-1-1:EGCG と EGC の比較試験(ガレート型カテキンと遊離型カテキン の比較)および EGCG と GCG の比較試験(ガレート型カテキンと熱異性化ガ レート型カテキンの比較) Ikeda らの方法に準じて実験を行った 27)。タウロコール酸ナトリウム、コレス テロールおよびホスファチジルコリン(PC)含有胆汁酸ミセルを超音波処理に より調製した(Table 2-1)。この胆汁酸ミセルを安定化させるため 37°C で 24 時 間インキュベートした後、ガレート型カテキンとして EGCG を、遊離型カテキ 16 ンとして EGC をそれぞれ 0, 1, 2 mM となるように添加した。また、別の実験に て、ガレート型カテキンとして EGCG を、熱異性化ガレート型カテキンとして GCG をそれぞれ 0, 1, 2 mM となるように添加した。37°C で 1 時間インキュベー トしたのち、220 nm シリンジフィルター(Whatman)でろ過を行い清澄なミセ ル溶液を得た。 コレステロール分析 内部標準物質として 5-cholestane 100 g 添加済みのねじ口チューブにミセル 層を 250 l サンプリングした。CHCl3 : MeOH = 2 : 1 (v/v) を 5 ml 添加し、40 °C、 30 min 脂質抽出を行った。1 ml の脱イオン水を添加し、転倒混和、1,000 rpm, 5 min 遠心分離した。水-MeOH 層を除去し、CHCl3 層を N2 気流下で dry up し た。Ethanolic KOH (EtOH : [H2O : KOH = 1 : 1 (w/w)] = 94 : 6 (v/v))を 5 ml 添加し、 50 °C、1 時間ケン化を行った。脱イオン水 5 ml、ヘキサン 5 ml 添加し、5 min 震 とう抽出、1,000 rpm, 5 min 遠心分離後、ヘキサン層を回収した。このヘキサン 抽出を計 3 回繰り返した。ヘキサンを N2 気流下で dry up 後、TMS 化試薬(ピ リジン:ヘキサメチルジシラザン:トリメチルクロロシラン=9:3:1 (v/v))を 0.2 ml 加え、室温で 30 min TMS 化を行った(ときどき攪拌する)。N2 気流下で dry up 後、ヘキサンを 1 ml 添加し、3,000 rpm, 5 min 遠心分離した。上清を採取 し、N2 気流下で dry up した後、少量のヘキサンに溶解し、GLC に供した。 コレステロールの GLC 分析条件 使用機器:GC14A(島津製作所) データ解析機器:クロマトパック CR8A(島津製作所) カラム:SPBTM-1 (0.25 mm × 60 m、0.25 m フィルム厚、Supelco) 17 キャリアーガス:ヘリウム 検出器:FID カラム温度:280 °C 注入口温度:300 °C 検出器温度:300 °C カラム流速:2.00 ml/min スプリット比:50 : 1 PC 分析(PC 由来脂肪酸分析) 内部標準物質として pentadecanoic acid 250 g 添加済みのねじ口チューブにミ セル層を 250 l サンプリングした。CHCl3: MeOH = 2 : 1 (v/v) を 5 ml 添加し、 40 °C、30 min 脂質抽出を行った。1 ml の脱イオン水を添加し、転倒混和、1,000 rpm, 5 min 遠心分離した。水-MeOH 層を除去し、CHCl3 層を N2 気流下で dry up した。硫酸-メタノールによるトランスメチル化法を行った後、少量のヘキサン に溶解し、GLC に供した。 PC 由来脂肪酸の GLC 分析条件 使用機器:HP6890(アジレントテクノロジーズ) データ解析機器:Chemstation(アジレントテクノロジーズ) カラム:DB-WAX (0.32 mm × 30 m、0.25 m フィルム厚、アジレントテクノロ ジーズ) キャリアーガス:ヘリウム 検出器:FID カラム温度:200 °C 18 注入口温度:250 °C 検出器温度:250 °C カラム流速:2.40 ml/min スプリット比:50 : 1 実験 2-1-2:各種リン脂質の比較試験 コレステロールおよび各種リン脂質含有胆汁酸ミセルを調製した(Table 2-1-2)。この胆汁酸ミセルを安定化させるため 37°C で 24 時間インキュベート した後、ガレート型カテキンとして、EGCG を 0, 1, 2 mM となるように添加した。 37°C で 1 時間インキュベートしたのち、220 nm シリンジフィルター(Whatman) ろ過を行い清澄なミセル溶液を得た。その後のコレステロール分析、PC 分析は 実験 2-1-1 と同様に行った。 実験 2-1-3:生理的条件に近い胆汁酸ミセル組成での検討 Ikeda らの方法に準じて実験を行った 15) 。コレステロール、PC、脂肪酸(オ レイン酸)およびモノオレオイルグリセロールで調製した(Table 2-1-3)。この 胆汁酸ミセルを安定化させるため 37°C で 24 時間インキュベートした後、ガレ ート型カテキンとして、EGCG を 0, 1, 2 mM となるように添加した。37°C で 1 時間インキュベートしたのち、220 nm シリンジフィルター(Whatman)でろ過 を行い清澄なミセル溶液を得た。その後のコレステロール分析、PC 分析は実験 2-1-1 と同様に行った。 統計解析 全ての結果は平均値 ± 標準誤差で標記した。統計検定は一元配置分散分析あ 19 るいは二元配置分散分析により行い、有意差が見られた場合は Bonferroni/Dunn の多重比較検定で群間比較を行い、P < 0.05 で有意差ありとした。 結果 実験 2-1-1:EGCG と EGC の比較試験(ガレート型カテキンと遊離型カテキン の比較)および EGCG と GCG の比較試験(ガレート型カテキンと熱異性化ガ レート型カテキンの比較) 各種カテキン無添加での胆汁酸ミセルに溶解したコレステロール量はそれぞ れ 94.2 %, 91.0 % であった(Fig 2-1-1 A and C)。この値を 100 % として各種カ テキン添加時の胆汁酸ミセルに残存するコレステロール量を示した。各種カテ キン無添加での胆汁酸ミセルに溶解した PC 量はそれぞれ 101 %, 105 % であっ た(Fig 2-1-1 B and D) 。この値を 100 % として各種カテキン添加時の胆汁酸ミ セルに残存するコレステロール量を示した。ガレート型カテキンである EGCG および GCG は添加量依存的にコレステロールの胆汁酸ミセル溶解性を低下さ せた(Fig 2-1-1 C)。また、ガレート型カテキンである EGCG および GCG は添 加量依存的に PC の胆汁酸ミセル溶解性を低下させた(Fig 2-1-1 D)。一方、遊 離型カテキンである EGC はコレステロールの胆汁酸ミセル溶解性をわずかに 低下させた(Fig 2-1-1 A)。また、遊離型カテキンである EGC は PC の胆汁酸ミ セル溶解性をわずかに低下させた(Fig 2-1-1 B)。EGCG, GCG, EGC のコレステ ロールの胆汁酸ミセル溶解性低減効果の強弱は、我々の以前の報告 27) と同様で あった。 実験 2-1-2:各種リン脂質の比較試験 実験 2-1-1 にて、特にガレート型カテキンがコレステロールだけでなく、PC 20 の胆汁酸ミセル溶解性を低下させた。そこで、胆汁酸ミセル中のリン脂質とし て PC, PA, PE, PI および PS を含有する 5 種類の胆汁酸ミセルを調製し、EGCG 添加におけるコレステロールおよび各種リン脂質の胆汁酸ミセル溶解性につい て検討を行った。各種カテキン無添加での胆汁酸ミセルに溶解したコレステロ ール量は PC, PA, PE, PI および PS それぞれ 85.5 %, 91.0 %, 95.4 %, 84.0 % およ び 94.8 % であった(Fig 2-1-2 A)。この値を 100 % として各種カテキン添加時 の胆汁酸ミセルに残存するコレステロール量を示した。各種カテキン無添加で の胆汁酸ミセルに溶解したリン脂質量は PC, PA, PE, PI および PS それぞれ 80.3 %, 86.2 %, 92.3 %, 107 % および 127 % であった(Fig 2-1-2 B)。この値を 100 % として各種カテキン添加時の胆汁酸ミセルに残存するリン脂質量を示し た。その結果、PC 以外のリン脂質含有胆汁酸ミセルでは、EGCG のコレステロ ールおよびリン脂質の胆汁酸ミセル溶解性低減効果はほとんど認められなかっ た(Fig 2-1-2 A and B)。 実験 2-1-3:生理的条件に近い胆汁酸ミセル組成での検討 実験 2-1-1 および実験 2-1-2 では、最もシンプルである胆汁酸、コレステロー ル、リン脂質を含む胆汁酸ミセル組成での検討であった。しかしながら、in vivo では、トリアシルグリセロールの加水分解物であるモノオレオイルグリセロー ルや遊離脂肪酸が含まれる。そこで、これら 2 成分を追加して胆汁酸ミセルを 調製し、EGCG 添加におけるコレステロールおよび総脂肪酸(PC、モノオレオ イルグリセロールおよびオレイン酸由来)の胆汁酸ミセル溶解性について検討 を行った。EGCG 無添加での胆汁酸ミセルに溶解したコレステロールおよび総 脂肪酸量は 98.0 % および 120 % であった(Fig 2-1-3)。この値を 100 % として EGCG 添加時の胆汁酸ミセルに残存するコレステロールおよび総脂肪酸量を示 21 した。その結果、モノアシルグリセロールや遊離脂肪酸を追加して調製した胆 汁酸ミセルでは、EGCG のコレステロールおよび総脂肪酸の胆汁酸ミセル溶解 性低減効果はほとんど認められなかった(Fig 2-1-3)。 22 Table 2-1-1 胆汁酸ミセル組成(pH 6.8) 0.5 mM Cholesterol 6.6 mM Sodium taurocholate 0.6 mM PC 132 mM NaCl 15 mM Sodium phosphate (NaH2PO4・2H2O) PC: phosphatidylcholine from egg yolk Table 2-1-2 胆汁酸ミセル組成(pH 6.8) 0.5 mM Cholesterol 6.6 mM Sodium taurocholate 0.6 mM PC, PA, PE, PI or PS 132 mM NaCl 15 mM Sodium phosphate (NaH2PO4・2H2O) PC: phosphatidylcholine from egg yolk, PA : phosphatidic acid from egg yolk, PE : phosphatidylethanolamine from egg yolk, PI : phosphatidylinositol from soybean, PS : phosphatidylserine from soybean Table 2-1-3 胆汁酸ミセル組成(pH 6.8) 0.5 mM Cholesterol 6.6 mM Sodium taurocholate) 0.6 mM PC 1 mM OA 0.5 mM MO 132 mM NaCl 15 mM Sodium phosphate (NaH2PO4・2H2O) PC: phosphatidylcholine from egg yolk OA: oleic acid MO: 1-monooleoylglycerol 23 Fig. 2-1-1 EGCG、EGC および GCG のコレステロールおよびホスファチジルコリンの胆汁酸ミ セル溶解性への影響 Comparison of effect of EGCG and EGC on micellar solubility of cholesterol (A) and phosphatidylcholine (B) in vitro and comparison of effect of EGCG and GCG on micellar solubility of cholesterol (C) and phosphatidylcholine (D) in vitro. Data are means ± SE of triplicate experiments. Means not sharing a common letter differ significantly (P < 0.05). Two-way ANOVA: (A–D) effect of catechins type, P < 0.0001; effect of catechin concentration, P < 0.0001; interaction between catechins type and catechin concentration, P < 0.0001. 24 Fig. 2-1-2 EGCG のコレステロール(A) および各種リン脂質(B) の胆汁酸ミセル 溶解性への影響 Data are means ± SE of triplicate experiments. Means not sharing a common letter differ significantly (P < 0.05). Two-way ANOVA(A, B) : effect of phospholipid type, P < 0.0001; effect of EGCG concentration, P < 0.0001; interaction between phospholipid type and EGCG concentration, P < 0.0001. 25 Micellar concentrations (% of 0 mM) C holesterol T otal fatty acids 120 100 a ab b 0 mM 1 mM 2 mM 80 60 40 20 0 E GC G added (mM) Fig. 2-1-3 トリアシルグリセロール加水分解物を含有する胆汁酸ミセルにおけ る EGCG のコレステロールおよび総脂肪酸の胆汁酸ミセル溶解性への影響 Data are means ± SE of triplicate experiments. Means not sharing a common letter differ significantly (P < 0.05). 26 第2章 胆汁酸ミセルおよびリン脂質ベシクルへのカテキン添加の影響 第2節 リン脂質ベシクルに及ぼすカテキン添加の影響 第 2 章第 1 節にて、茶カテキンのうち特にガレート型カテキンがコレステロ ールだけでなく、PC の胆汁酸ミセル溶解性を低下させた。その他のリン脂質で はコレステロールやリン脂質の胆汁酸ミセル溶解性を低下させなかった。この ことは、ガレート型カテキンが胆汁酸ミセルから PC の溶解性を低下させるこ とで、コレステロールの胆汁酸ミセル溶解性を低下させる可能性を示唆した。 そこで、本節では、茶カテキンが各種リン脂質の溶解性を低下させるかどうか 簡便的に評価するため、リン脂質ベシクルに及ぼすカテキン添加の影響の検討 を行った。 実験方法 実験 2-2-1:各種リン脂質の比較試験 PC, PA, PE, PI および PS に超純水を加え、超音波処理を行い、5 種類の 0.6 mM リン脂質ベシクルを調製した。ガレート型カテキンとして、EGCG を 0, 2 mM となるように添加した。37°C で 1 時間インキュベートしたのち、25,000 × g で 1 時間遠心操作を行った。この遠心操作は、茶カテキンとリン脂質が相互作用し ている場合は沈殿が生じることを期待して行った。なお、この遠心操作条件で はリン脂質単独では沈殿せず、リン脂質ベシクルの溶解性に影響しないことは 予備実験にて確認した。220 nm シリンジフィルター(Whatman)でろ過を行い 清澄な溶液を得た。その後第 1 節の PC 分析の際と同様の脂質抽出をおこなっ た後、バートレット法 74)に準じてリン脂質濃度を定量した。 27 実験 2-2-2:各種カテキンの比較試験 PC に超純水を加え超音波処理を行い、0.6 mM PC ベシクルを調製した。EGCG, GCG, EGC を 0, 0.5, 1, 2 mM となるように添加した。37°C で 1 時間インキュベー トしたのち、25,000 × g で 1 時間遠心操作を行った。220 nm シリンジフィルタ ーろ過を行い清澄な溶液を得た。その後第 1 節の PC 分析の際と同様の脂質抽 出をおこなった後、バートレット法 74)に準じてリン脂質濃度を定量した。 結果 実験 2-2-1:各種リン脂質の比較試験 ガレート型カテキンである EGCG 添加によって、ベシクル中の PC 濃度が低 下した。ベシクル中の PS 濃度はわずかに低下し、その他の 3 種のリン脂質濃 度への影響は認められなかった(Fig. 2-2-1) 。 実験 2-2-2:各種カテキンの比較試験 ガレート型カテキンである EGCG および GCG 添加によって、ベシクル中の PC 濃度はカテキン添加量依存的に低下した。遊離型カテキンである EGC 添加 でもベシクル中の PC 濃度はカテキン添加量依存的に低下したものの、その作用 はガレート型カテキンである EGCG および GCG よりも弱かった。(Fig. 2-2-2)。 28 PC PA PE PI PS Vesicular phospholipid concentrations (%) 120 ab ab ab ab a a b 100 bc c 80 60 40 d 20 0 0 2 EGCG added (mmol/L) Fig.2-2-1 EGCG の各リン脂質種のベシクル溶解性への影響 The vesicular phospholipid concentration at 0 mmol/L of EGCG was adjusted to 100%. Data are means ± SE of triplicate experiments. Means not sharing a common letter differ significantly (P < 0.05). Two-way ANOVA: effect of phospholipid type, P < 0.0001; effect of EGCG concentration, P < 0.0001; interaction between phospholipid type and EGCG concentration, P < 0.0001. 29 Vesicular phosphatidylcholine concentrations (%) EGCG GCG EGC 120 a a a a 100 b c 80 60 d d 40 fg 20 e f g 0 0 0.5 1 2 Catechins added (mmol/L) Fig.2-2-2 EGCG、GCG および EGC のホスファチジルコリンのベシクル溶解性へ の影響 The vesicular phosphatidylcholine concentration at 0 mmol/L of tea catechins was adjusted to 100%. Data are means ± SE of triplicate experiments. Means not sharing a common letter differ significantly (P < 0.05). Two-way ANOVA: effect of phospholipid type, P < 0.0001; effect of EGCG concentration, P < 0.0001; interaction between phospholipid type and EGCG concentration, P < 0.0001. 30 第2章 胆汁酸ミセルおよびリン脂質ベシクルへのカテキン添加の影響 第3節 ホスファチジルコリンのコレステロールのミセル溶解性への影響 第 2 章第 1 節にて、茶カテキンのうち特にガレート型カテキンがコレステロ ールだけでなく、PC の胆汁酸ミセル溶解性を低下させた。このことは、ガレー ト型カテキンが胆汁酸ミセルから PC を除去することで、コレステロールの胆 汁酸ミセル溶解性を低下させる可能性を示唆した。また、第 2 章第 2 節にて、 茶カテキンのうち特にガレート型カテキンがリン脂質のなかでも特に PC のベ シクル溶解性を低下させた。このことから、ガレート型カテキンが胆汁酸ミセ ルから PC を除去することで、コレステロールの胆汁酸ミセル溶解性を低下さ せる可能性が考えられた。そこで本節では、PC 濃度の異なる胆汁酸ミセルを調 製し、その際のコレステロールの胆汁酸ミセル溶解性をみることで、胆汁酸ミ セル中の PC 濃度と比例してコレステロールの胆汁酸ミセル溶解性が低下する かどうか検討をおこなった。 実験方法 Table 2-3-1 の組成からなる PC 濃度の異なる 4 種類のミセル (pH 6.8) を超音 波処理により作成し、37℃ で 24 hr インキュベート(ミセルを安定化させるた め)した。220 nm シリンジフィルター(Whatman)でろ過を行い清澄なミセル 溶液を得た。その後のコレステロール分析は第 1 節の実験 2-1-1 と同様に行った。 31 結果 PC 濃度を 0.4 mM とした場合、PC 濃度が 0.6 mM の場合と同様にほとんどの コレステロールは胆汁酸ミセルに溶解した。PC 濃度を 0.2 mM とした場合、PC 濃度が 0.6 mM の場合と比較して若干コレステロールの胆汁酸ミセルへの溶解量 は低下した。PC を含まない場合では、ほとんどのコレステロールはミセルに溶 解しなかった(Fig. 2-3-1)。PC 濃度と比例してのコレステロールの胆汁酸ミセ ルへの溶解量の低下は認められなかった。 32 C holesterol concentration i n micelles (mM) Table 2-3-1 胆汁酸ミセル組成 0.6mM 0.4mM PC (mM) 0.6 0.4 Cholesterol (mM) 0.5 0.5 Sodium taurocholate (mM) 6.6 6.6 NaCl (mM) 132 132 Sodium phosphate (mM) 15 15 PC: phosphatidylcholine from egg yolk 0.2mM 0.2 0.5 6.6 132 15 0mM 0 0.5 6.6 132 15 600 a a 500 b 400 300 200 100 c 0 0.6 0.4 0.2 0 P C concentration (mM) Fig. 2-3-1 ホスファチジルコリン濃度を変えて調製した場合の胆汁酸ミセルへ のコレステロールの溶解性 Data are means ± SE of triplicate determinations. Means not sharing a common letter significantly differ at P < 0.05. 33 第2章 胆汁酸ミセルおよびリン脂質ベシクルへのカテキン添加の影響 第4節 コレステロールおよびホスファチジルコリンの胆汁酸ミセルへの 親和性に及ぼす EGCG 添加の影響 第 2 章第 1 節では、ガレート型カテキンが PC 含有胆汁酸ミセルのみで、コ レステロールおよびリン脂質の胆汁酸ミセルへの溶解性を低下させることを示 した。一方で、モノアシルグリセロールや遊離脂肪酸含有胆汁酸ミセルでは、 EGCG のコレステロールおよび PC の胆汁酸ミセル溶解性低減効果はほとんど認 められなかった。この結果は、茶カテキンが生体内でコレステロールのミセル 溶解性を低下させることでコレステロール吸収を抑制するという、これまでの 考えが正しくない可能性を示唆した。コレステロールの胆汁酸ミセルへの親和 性が強まると、コレステロールが胆汁酸ミセルから放出されにくく吸収されに くいことが報告されている 75) 唆する報告がなされている 70-73) 。また、コレステロールと PC との相互作用を示 。そこでコレステロールおよび PC の胆汁酸ミ セルへの親和性に与える EGCG および EGC の影響について検討を行った。 実験方法 胆汁酸ミセルはコレステロール、PC、オレイン酸およびモノオレオイルグリ セロールで調製した(Table 2-4-1)。この胆汁酸ミセルを安定化させるため 37°C で 24 時間インキュベートした後、ガレート型カテキンとして EGCG を、遊離 型カテキンとして EGC をそれぞれ 0, 5, 10 mM となるように添加した。37°C で 1 時間インキュベートしたのち、220 nm シリンジフィルター(Whatman)でろ過 した胆汁酸ミセル 1.5 ml に等量の 1-オクタノールを添加し、37 °C で 10 min 震 とう(170 oscillations/min)。1,000 rpm, 10 min 遠心分離処理を行い、1-オクタノー 34 ル層およびミセル層を回収し、それぞれのコレステロールおよび PC 濃度を測定 した。1-オクタノールへのコレステロールおよび PC の移行率および分配係数へ の影響を検討した。なお、Ikeda らは 1-オクタノールでなく、トリオレインを用 いて植物ステロールの胆汁酸ミセルとの親和性への影響の検討を行っている 75) 。 EGCG はトリオレインには不溶であり、EGCG がコレステロールあるいは PC と相互作用する場合、複合体の移行が妨げられる可能性が考えられた。そこで、 これら 3 分子が溶解できる溶媒として 1-オクタノールを用いた。 予備実験の結果、10 min 震とう(170 oscillations /min) によって本実験を実施 することとした(5, 10, 20, and 30 min 震とうでコレステロールと PC の 1-オクタ ノールへの移行率は直線的に増加し、30 min ではほぼ全ての PC が 1-オクタノ ールへ移行した)。 コレステロール濃度測定 (1-オクタノール層) 内部標準物質として 5-cholestane 100 g 添加済みのねじ口チューブに 1-オクタ ノール層を 400 l サンプリングした。N2 気流下で 1-オクタノールを dry up 後、 CHCl3 : MeOH = 2 : 1 (v/v) を 5 ml 添加し、40 °C、30 min 脂質抽出。1 ml の脱 イオン水を添加し、転倒混和後、1,000 rpm, 5 min 遠心分離処理し、水-MeOH 層 を除去、CHCl3 層を N2 気流下で dry up した。Ethanolic KOH (EtOH : [H2O : KOH = 1 : 1 (w/w)] = 94 : 6)を 5 ml 添加し、50 °C、1 hr ケン化。脱イオン水 5 ml、ヘ キサン 5 ml 添加し、5 min 震とう抽出し、1,000 rpm, 5 min 遠心分離処理後、ヘ キサン層を回収した。このヘキサン抽出を計 3 回繰り返す。第 2 章第 1 節と同 様の操作にて TMS 化後、GLC に供した。 (胆汁酸ミセル層) 35 内部標準物質として 5-cholestane 100 g 添加済みのねじ口チューブに胆汁酸ミ セル層を 400 l サンプリングした後、CHCl3 : MeOH = 2 : 1 (v/v) を 6 ml 添加し、 40 °C、30 min 脂質抽出した。1 ml の脱イオン水を添加し、転倒混和後、1,000 rpm, 5 min 遠心分離し、水-MeOH 層を除去、CHCl3 層を N2 気流下で dry up した。 ここからは 1-オクタノール層と同様の操作をおこなった。 PC 濃度測定 (1-オクタノール層) 1-オクタノール層を 400 l サンプリングした。N2 気流下で dry up した後、バー トレット法 74)に準じて定量した。 (胆汁酸ミセル層) 胆汁酸ミセル層を 400 l サンプリングした。1-オクタノール層のコレステロー ル濃度測定時と同様の脂質抽出をおこなった後、バートレット法 74) に準じて定 量した。 結果 コレステロールおよび PC の 1-オクタノール層への移行率および分配係数は、 EGCG 5 mM および 10 mM 添加により抑制された。EGC 添加では、この抑制作 用は認められなかった(Fig. 2-4-1 and Fig. 2-4-2)。このことから、EGCG はコレ ステロールおよび PC の胆汁酸ミセルへの親和性を強める作用があることが考 えられた。 36 Table 2-4-1 胆汁酸ミセル組成 0.5 mM Cholesterol 6.6 mM Sodium taurocholate 0.6 mM PC 1 mM OA 0.5 mM MO 132 mM NaCl 0.1 M TES + 0.1 M NaCl buffer (pH 6.8) PC: phosphatidylcholine from egg yolk OA: oleic acid MO: 1-monooleoylglycerol 37 Fig. 2-4-1 EGCG および EGC のコレステロールの胆汁酸ミセルとの親和性へ の影響(上図;1-オクタノールへのコレステロールの移行率、下図;コレステロ ールの分配係数) Data are means ± SE of 4 experiments. Means not sharing a common letter significantly differ at P < 0.05. 38 Fig. 2-4-2 EGCG および EGC のホスファチジルコリンの胆汁酸ミセルとの親 和性への影響(上図;1-オクタノールへのホスファチジルコリンの移行率、下図; ホスファチジルコリンの分配係数) Data are means ± SE of 4 experiments. Means not sharing a common letter significantly differ at P < 0.05. 39 考察 消化管に流入した脂質はエマルジョン化された後、エマルジョン表層に胆汁 酸が作用し、ベシクルを経て胆汁酸ミセルが形成される 76) 。コレステロールが ヒト消化管から吸収されるには胆汁酸ミセルへの溶解が必須条件である 77) 。コ レステロールの胆汁酸ミセル溶解量は総脂質濃度や胆汁酸種だけでなく、リン 脂質と胆汁酸の比率によって影響を受けることが in vitro 実験の結果から報告 されている 78) 。これまで、ガレート型カテキンを胆汁酸ミセルに添加すると、 すみやかに白濁し沈殿を生じること、ガレート型カテキン添加量依存的にコレ ステロールの沈殿量が増加すること、沈殿物中の EGCG 量とコレステロールの 沈殿量が高い相関関係を示すことから 26) 、ガレート型カテキンがコレステロー ルと結合することによりコレステロールのミセル溶解性を低下させることでコ レステロール吸収を抑制すると考えられてきた。コレステロールは疎水性分子 のため、ガレート型カテキン分子内の疎水性領域と疎水性相互作用する可能性 が考えられる 70) ものの、どのようにしてガレート型カテキンが胆汁酸ミセル中 のコレステロールを沈殿させるのかはいまだ明らかにされていない。近年、ガ レート型カテキンのガロイル基とリン脂質との相互作用 ステロールの沈殿 70-73) が報告され、コレ 26, 27) と何らかの関係があると考えられるものの、この点に関 する情報はない。そこで、まずはコレステロールだけでなくリン脂質の胆汁酸 ミセル溶解性に及ぼすカテキン添加の影響検討を行った。その結果、特にガレ ート型カテキンがコレステロールだけでなく、PC の胆汁酸ミセル溶解性を低下 させることが明らかとなった(Fig. 2-1-1)。また、PC 以外のリン脂質含有胆汁 酸ミセルでは、EGCG のコレステロールおよびリン脂質の胆汁酸ミセル溶解性 低減効果はほとんど認められないことを示した(Fig. 2-1-2)。これらは、カテキ 40 ンのコレステロールのミセル溶解性低下作用に対する PC の関与を示唆し、カ テキンが直接コレステロールと結合沈殿するというこれまでの考えが正しくな い可能性を示唆した。すなわち、PC を沈殿させることでコレステロールの溶解 性を低下させる可能性、あるいは、ガレート型カテキンとコレステロールおよ び PC の 3 分子種の複合体を形成して沈殿する可能性が考えられた。 我々は通常リン脂質を 2~8 g/日程度摂取していること、胆汁中のリン脂質が 10~20 g/日程度消化管に流入しそのリン脂質のほとんどが PC であることから 79) 、消化管に流入するリン脂質の大半は PC であり、ガレート型カテキンは小腸 内腔で十分な作用を発揮しうると考えられる。また、ガレート型カテキンであ る EGCG 添加によって、ベシクル中の PC 濃度が低下した。ベシクル中の PS 濃 度はわずかに低下し、その他の 3 種のリン脂質濃度への影響は認められなかっ た(Fig. 2-2-1)。さらに、ガレート型カテキンである EGCG および GCG 添加に よって、ベシクル中の PC 濃度はカテキン添加量依存的に低下した。遊離型カテ キンである EGC 添加でもベシクル中の PC 濃度はカテキン添加量依存的に低下 したものの、その作用はガレート型カテキンである EGCG および GCG よりも弱 かった。(Fig. 2-2-2)。このことから、ガレート型カテキンがリン脂質の中でも PC のみと相互作用することが示唆された。また、このガレート型カテキンと PC 相互作用が PC の溶解性を低下させ、コレステロールの溶解性を低下させる ことが示唆された。 そこで、PC の溶解性の低下がコレステロールの胆汁酸ミセルへの溶解性をど の程度低下させるか第 3 節にて検討を行った。その結果、PC 濃度に比例したコ レステロールの胆汁酸ミセルへの溶解量の低下は認められず、胆汁酸ミセルか らの PC の除去がコレステロールの溶解性の低下を引き起こすことは証明でき なかった(Fig. 2-3-1) 。しかし、この試験方法は、すでにコレステロールが胆汁 41 酸ミセルに溶解しているところから PC を除去したわけではない。そのため、 すでにコレステロールが胆汁酸ミセルに溶解しているところから徐々に PC の みを除去できる試験系の確立が今後必要と考えられた。 また、第 2 章第 1 節では、生理的条件に近いモノアシルグリセロールや遊離 脂肪酸含有胆汁酸ミセルでは、EGCG のコレステロールおよび PC の胆汁酸ミセ ル溶解性低減効果はほとんど認められなかった。この結果もまた茶カテキンが 生体内でコレステロールのミセル溶解性を低下させることでコレステロール吸 収を抑制するというこれまでの考えが正しくない可能性を示唆した。我々は、 茶カテキンをコレステロールを含む脂質エマルジョンとともにラットに投与す るとコレステロールの吸収が抑制されることを報告した 26, 27) 。脂質エマルジョ ン中のコレステロールは生体内で胆汁酸ミセルに溶解した後吸収されるため、 この 2 つの実験 26, 27) でもラット小腸内腔でコレステロールを沈殿させずともコ レステロールの吸収を抑制した可能性が考えられた 26, 27)。 この吸収過程では、胆汁酸ミセルごと小腸上皮細胞に取り込まれるのではな く、胆汁酸ミセルからコレステロールなどの内容物がモノマーとして放出され て、小腸上皮細胞に取り込まれる 76) 。コレステロールの胆汁酸ミセルへの親和 性が強まると、コレステロールが胆汁酸ミセルから放出されにくく吸収されに くいことが報告されている されている 75) 。カテキンと PC が相互作用を示唆する報告がな 70-73) ことから、コレステロールおよび PC の胆汁酸ミセルへの親和 性に与える EGCG および EGC の影響について検討を行った。その結果、EGCG はコレステロールおよび PC の胆汁酸ミセルへの親和性を強める作用があるこ とが示され(Fig. 2-4-1 and Fig. 2-4-2)、カテキンと PC の相互作用がコレステロ ールの胆汁酸ミセルへの親和性を強めることでコレステロールの吸収を抑制す る可能性が考えられた。今後リン脂質種を変えた胆汁酸ミセル(PC, PA, PE, PI, 42 and PS)にて EGCG 添加の影響を検討する必要があると考えられた。しかしな がら、この試験方法が、生体内での現象を正確に反映するかどうかは不明であ り、実際にカテキンがコレステロールの胆汁酸ミセルへの親和性を強めること でコレステロール吸収抑制作用を発揮するかは明らかにできておらず、さらな る検討が必要と考えられた。 本章の結果から、カテキンがコレステロール吸収抑制作用を発揮するには PC の関与が示唆された。そこで次章では、EGCG が胆汁酸ミセルやその構成成分 と相互作用するのかどうか、各種 NMR 法を用いて検討を行った。 小括 コレステロール-PC 含有胆汁酸ミセルを調製し、コレステロールだけでなく リン脂質の胆汁酸ミセル溶解性に及ぼすカテキン添加の影響について検討を行 った。その結果、特にガレート型カテキンがコレステロールだけでなく、PC の 胆汁酸ミセル溶解性を低下させること、PC 以外のリン脂質含有胆汁酸ミセルで は、EGCG のコレステロールおよびリン脂質の胆汁酸ミセル溶解性低減効果は ほとんど認められないことを明らかにした。これらの結果は、カテキンのコレ ステロール溶解性低下作用に対する PC の関与を示唆し、カテキンが PC の溶解 性を低下させることでコレステロールの溶解性をも低下させる可能性が考えら れた。 そこで、リン脂質のみからなるベシクルを調製し、茶カテキンがリン脂質の 溶解性を低下させるかどうか検討を行った。その結果、茶カテキンのうち特に ガレート型カテキンがリン脂質のなかでも特に PC のベシクル溶解性を低下さ せた。このことから、ガレート型カテキンが PC の溶解性を低下させることで、 43 コレステロールの胆汁酸ミセル溶解性をも低下させる可能性が考えられた。 そこで、PC の溶解性の低下がコレステロールの胆汁酸ミセルへの溶解性をど の程度低下させるのか、コレステロール-PC 含有胆汁酸ミセル中の PC 濃度を 変化させて調製し、その際のコレステロール溶解量について検討を行った。そ の結果、PC 濃度と比例してのコレステロールの胆汁酸ミセルへの溶解量の低下 は認められず、胆汁酸ミセルからの PC の除去がコレステロールの溶解性の低 下を引き起こすことは証明できなかった。しかし、この試験方法は、すでにコ レステロールが胆汁酸ミセルに溶解しているところから PC を除去したわけで はない。そのため、すでにコレステロールが胆汁酸ミセルに溶解しているとこ ろから徐々に PC のみを除去できる試験系の確立を今後検討する必要が考えら れた。 一方で、生理的条件に近いコレステロール-PC-MO-OA 含有胆汁酸ミセルを調 製し、EGCG 添加の影響について検討を行った。その結果、EGCG によるコレ ステロールの胆汁酸ミセル溶解性低減効果はほとんど認められなかった。この ことから、カテキンがコレステロール溶解性を低下させずとも、PC との相互作 用を介してコレステロール吸収を抑制する可能性が考えられた。 そこで、コレステロールおよび PC の胆汁酸ミセルへの親和性に与える EGCG および EGC の影響について検討を行った。その結果、EGCG はコレステロール および PC の胆汁酸ミセルへの親和性を強める作用があることが示され、カテキ ンと PC の相互作用がコレステロールの胆汁酸ミセルへの親和性を強めること でコレステロールの吸収を抑制する可能性が考えられた。今後リン脂質種を変 えた胆汁酸ミセル(PC, PA, PE, PI, and PS)にて EGCG 添加の影響を検討する必 要があると考えられた。しかしながら、この試験方法が、生体内での現象を正 確に反映するかどうかは不明であり、実際にカテキンがコレステロールの胆汁 44 酸ミセルへの親和性を強めることでコレステロール吸収抑制作用を発揮するか は明らかにできておらず、さらなる検討が必要であると考えられた。 45 第3章 カテキンと胆汁酸ミセルとの相互作用解析 第1節 1 H-NMR によるカテキンと胆汁酸ミセルとの相互作用解析 第 2 章の結果から、カテキンがコレステロール吸収抑制作用を発揮するには PC の関与が示唆された。Kumazawa らは、EGCG 分子がリン脂質二重層(PC を 使用)と相互作用することを、31P および 2H を用いた固体核磁気共鳴法(固体 NMR)にて証明した 71)。さらに同じ研究グループの Uekusa らは、ガレート型 カテキンである EGCG および ECG が、脂質膜(PC を使用)表面で PC のトリ メチルアンモニウム基を介して相互作用(cation-相互作用)することを、溶液 NMR 法を用いて示した 72)。さらに Uekusa らは、EGCG および ECG がその分 子内にて B 環およびガロイル基平面が-相互作用によってスタッキング構造 をとること、この-相互作用が EGCG および ECG とホスファチジルコリンと の cation-相互作用を増強する可能性を示した 73)。これらのことから、胆汁酸 ミセル中でもガレート型カテキンのガロイル基と PC が相互作用する可能性が 考えられた。また、カテキンがコレステロール吸収抑制作用を発揮するために はこの相互作用が重要であることが推察される。そこで本章では、EGCG が胆 汁酸ミセルやその構成成分と相互作用するのかどうか、各種 NMR 法を用いて 検討を行った。まず本節では、コレステロール-PC 含有胆汁酸ミセルおよびコレ ステロール-PC-MO-OA 含有胆汁酸ミセルに EGCG を添加し、EGCG のプロト ンのシグナルの変化を調べることで相互作用を解析することを目的とした。 試薬 実験に用いた試薬は以下の会社から購入した。なお、ここに記載以外の試薬 46 は第 2 章に記載のものと同じものを用いた。また、D 化 EGCG(EGCG, 4-d1 およ び EGCG, 4, 4-d2) は東北大学大学院薬学研究科、土井隆行教授および吉田将人 助教により化学合成されたものを御提供頂いた。 「和光純薬工業」 Sodium 2,2-silapentane-5-sulfonate (DSS), 2-(9-anthroyloxy) stearic acid (2-SA), 12-(9-anthroyloxy) stearic acid (12-SA) 「関東化学」 Deuterium oxide (D2O; deuterium purity, 99.8 %) 実験方法 実験 3-1-1:1H-NMR による EGCG とコレステロール-PC 含有胆汁酸ミセルとの 相互作用解析 D2O と、NaH2PO4 を D2O により D 化させた NaD2PO4 を用い、コレステロー ル-PC 含有胆汁酸ミセル溶液を調製した(Table 2-1-1 の組成に準じた)。EGCG の粉末を EGCG のモル濃度が 0.5 mM となるように、胆汁酸ミセル溶液に添加、 混合し、NMR 測定用試料 1 ml とした。これに内部標準物質として 1 mg/ml DSS を 20 l 添加した。室温で 1 時間静置後、混合物の 1H-NMR スペクトル測定を行 った。NMR 測定は Bruker BioSpin 社製 AVANCE III 400 を用いて行い、スペクト ル解析には同社製 Topspin 3.0 を用いた。EGCG の各プロトンのスペクトルの帰 属は Uekusa らの方法に準じて行った 72)。 1 H-NMR の測定条件は、以下の通りである。 <NMR 測定パラメータ> Program name: zg30 Resonance frequency: 399.7 MHz 47 Excitation pulse length: 14.0 s Pulse delay time: 1.0 s Spinning: 20.0 Hz Temperature: 300.0 K 実験 3-1-2:1H-NMR による EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミ セルとの相互作用解析 D2O と、NaD2PO4 を用い、コレステロール-PC-MO-OA 含有胆汁酸ミセル溶 液を調製した(Table 2-1-3 の組成に準じた)。EGCG の粉末を EGCG のモル濃度 が 0.5 mM となるように、胆汁酸ミセル溶液に添加、混合し、NMR 測定用試料 1 ml とした。これに内部標準物質として 1 mg/ml DSS を 20 l 添加した。室温で 1 時間静置後、混合物の 1H-NMR スペクトル測定を行った。1H-NMR の測定条件 は、実験 3-1-1 と同様で行った。 結果 実験 3-1-1:EGCG の化学構造を Fig. 3-1-1 に示した。EGCG とコレステロー ル-PC 含有胆汁酸ミセル溶液とを混合した 1H-NMR スペクトルを Fig. 3-1-2 に示 した。また、Table 3-1-1 には EGCG 単独の場合と、コレステロール-PC 含有胆汁 酸ミセル溶液を混合した場合の EGCG の 1H-NMR の化学シフト値を示した。 そして、その時の EGCG のそれぞれのプロトンの化学シフト変化量 Δ(コレス テロール-PC 含有胆汁酸ミセル溶液と混合した時の EGCG の化学シフト値− EGCG 単独の化学シフト値)を Fig. 3-1-3 に示した。 EGCG は、コレステロール-PC 含有胆汁酸ミセル溶液と混合することで、EGCG のプロトンの化学シフト値の変化が観測された。EGCG の B 環 (2′/6′位)および 48 ガロイル基 (2′′/6′′位)のプロトンのシグナルはコレステロール-PC 含有胆汁酸ミ セルと混合することで低磁場側へシフトした。このことから、EGCG の B 環お よびガロイル基の周囲の電子密度が低くなっていると考えられた。逆に、A 環 (6 位および 8 位)および C 環 (2 位および 3 位)のプロトンのシグナルはコレステロ ール-PC 含有胆汁酸ミセルと混合することで高磁場側へシフトした。このことか ら、EGCG の A 環および C 環の周囲の電子密度が高くなっていると考えられた。 ただし、EGCG の 4/4位のプロトンのシグナルはコレステロール-PC 含有胆汁 酸ミセル由来のプロトンのシグナルと重なってしまったために、解析できなか った。 以上のことから、EGCG はコレステロール-PC 含有胆汁酸ミセルと相互作用し ていることが示された。 実験 3-1-2:EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液とを混 合した 1H-NMR スペクトルを Fig. 3-1-4 に示した。また、Table 3-1-2 には EGCG 単独の場合と、コレステロール-PC-OA-MO 含有胆汁酸ミセル溶液を混合した場 合の EGCG の 1H-NMR の化学シフト値を示した。そして、その時の EGCG の それぞれのプロトンの化学シフト変化量 Δ(コレステロール-PC-MO-OA 含有胆 汁酸ミセル溶液と混合した時の EGCG の化学シフト値− EGCG 単独の化学シフ ト値)を Fig. 3-1-5 に示した。 EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液を混合することで、 EGCG のプロトンの化学シフト値の変化が観測された。それぞれの化学シフト 変化量は実験 3-1-1 のコレステロール-PC 含有胆汁酸ミセルの場合とほぼ一致し ていたことから、トリアシルグリセロール加水分解物である OA および MO は、 EGCG と胆汁酸ミセルとの相互作用への関与は低いことが推定された。 49 以上のことから、EGCG はコレステロール-PC 含有胆汁酸ミセルと同様にコレ ステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用をしていることが確認され た。 50 OH OH 2' 8 HO A 6 OH O C 4 B 2 OH 6' 3 O O 6" 2" HO OH OH Fig. 3-1-1 EGCG の化学構造 51 Fig. 3-1-2 コレステロール-PC 含有胆汁酸ミセル添加による EGCG の 1H-NMR ス ペクトル変化 A; EGCG 単独、B; EGCG-コレステロール-PC 含有胆汁酸ミセル 52 Table 3-1-1 EGCG 単独とコレステロール-PC 含有胆汁酸ミセル溶液と混合し た際の EGCG の 1H-NMR (400 MHz, 300 K, D2O at pD 6.8 with NaD2PO4 / NaCl) Position Free (ppm), (J in Hz) Complex (ppm), (J in Hz) 2′′/6′′ 2′/6′ 6 8 3 2 7.00, s 6.61, s 6.18, d (2.2) 6.15, d (2.2) 5.62, m 5.15, s 3.07, dd (17.3, 4.5) 2.94, dd (17.3, 1.4) 7.05, s 6.69, s 6.11, d (1.9) 6.09, d (1.9) 5.36, m 5.08, m ―* ―* 4 4 * コレステロール-PC 含有胆汁酸ミセル由来のシグナルと重なったために帰 属できなかった。 J; 結合定数(分裂したピークの間隔) s; singlet, d; doublet, m; multiplet, dd; double-doublet(プロトンのピークの分裂 数) 53 Fig. 3-1-3 コレステロール-PC 含有胆汁酸ミセルと混合した際の EGCG の化学シ フト変化量 54 Fig. 3-1-4 コレステロール-PC-MO-OA 含有胆汁酸ミセル添加による EGCG の 1 H-NMR スペクトル変化 A; EGCG 単独、B; EGCG-コレステロール-PC-MO-OA 含有胆汁酸ミセル 55 Table 3-1-2 EGCG 単独とコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液 と混合した際の EGCG の 1H-NMR (400 MHz, 300 K, D2O at pD 6.8 with NaD2PO4 / NaCl) Position Free (ppm), (J in Hz) Complex (ppm), (J in Hz) 2′′/6′′ 2′/6′ 6 8 3 2 7.00, s 6.61, s 6.18, d (2.2) 6.15, d (2.2) 5.62, m 5.15, s 3.07, dd (17.3, 4.5) 2.94, dd (17.3, 1.4) 7.05, s 6.68, s 6.11, d (1.9) 6.09, d (1.9) 5.39, m 5.07, s ―* ―* 4 4 * コレステロール-PC-MO-OA 含有胆汁酸ミセル由来のシグナルと重なったため に帰属できなかった。 J; 結合定数(分裂したピークの間隔) s; singlet, d; doublet, m; multiplet, dd; double-doublet(プロトンのピークの分裂 数) 56 化学シフト変化量 (ppm) 0.15 0.00 − 0.15 −0.30 2′′/6′′ 2′/6′ 6 8 3 2 Position Fig. 3-1-5 コレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と混合した際の EGCG の化学シフト変化量 57 第3章 カテキンと胆汁酸ミセルとの相互作用解析 第 2 節 DOSY 法による EGCG と胆汁酸ミセルとの相互作用解析 第 2 章第 1 節では、コレステロール-PC 含有胆汁酸ミセルと違い、生理的条件 に近いモノアシルグリセロールや遊離脂肪酸含有胆汁酸ミセルでは、EGCG の コレステロールおよび PC の胆汁酸ミセル溶解性低減効果はほとんど認められ なかった。これがモノアシルグリセロールや遊離脂肪酸が胆汁酸ミセル中に存 在することでコレステロールおよび PC の胆汁酸ミセル溶解性を維持している のか、EGCG とコレステロールあるいは PC との相互作用に影響をあたえている かどうか不明であった。本章第 1 節で EGCG はコレステロール-PC 含有胆汁酸 ミセルと同様にコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用をして いることが確認された。 異なる分子は分子量や立体構造の違いなどにより、その分子特有の拡散係数を持 つことが知られている。そして、異なる分子同士が相互作用することにより、包接 複合体が形成され、 “見かけ上、ひとつの分子”となるため、それぞれの拡散係数が 近い値を示すことが報告されている 80)。そこで、異なる視点から EGCG とコレス テロール-PC-OA-MO 含有胆汁酸ミセルとの相互作用を確認するため、EGCG お よびコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液の拡散係数、また、EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液を混合した際のそれぞれの 拡散係数を NMR の測定法の 1 つである DOSY (diffusion ordered spectroscopy) によ り測定することで、それらの拡散係数の変化を確認し、相互作用を解析すること を目的とした。 実験方法 D2O と、NaD2PO4 を用い、コレステロール-PC-MO-OA 含有胆汁酸ミセル溶 58 液を調製した(実験 3-1-2 と同様)。EGCG の粉末を EGCG のモル濃度が 1 mM となるように、胆汁酸ミセル溶液に添加、混合し、NMR 測定用試料 600 l とし た。これに内部標準物質として 1 mg/ml DSS を 20 l 添加した。室温で 1 時間静 置後、混合物の DOSY 測定を行い、拡散係数を算出した。 (2) DOSY 測定条件 DOSYの測定条件は、以下の通りである。 <NMR 測定パラメータ> Program name: ledbpgp2s Resonance frequency: 399.7 MHz Pulse delay time: 4.0 s Acquisition times: 0.004 (F1), 4.0 (F2) s Diffusion time: 170 ms Gradient pulse: 1.5 ms Data points: 32 (F1), 32768 (F2) Window functions: SINE (F1), EM (F2) Spinning: 0 Hz Temperature: 300.0 K 結果 EGCG 単独の場合の DOSY スペクトルを Fig. 3-2-1 に、コ レ ス テ ロ ー ル -PC-MO-OA 含有胆汁酸ミセル溶液単独の場合の DOSY スペクトルを Fig. 3-2-2 に、 EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液を混合した際の DOSY スペクトルを Fig. 3-2-3 に示した。また、Table 3-2-1 には DOSY 測定から得られた拡 散係数を示した。 DOSY 測定の結果、EGCG 単独の拡散係数 Dfree と、コレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と混合した場合の EGCG の拡散係数 Dobs とで違いが見られた。 59 EGCG 単独の拡散係数 Dfree は 3.67 × 10−10 m2/s(Fig. 3-2-1, Table 3-2-1)であったのに 対し、コレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と混合した際の EGCG の 拡散係数 Dobs は 6.49 × 10−10 m2/s(Fig. 3-2-3, Table 3-2-1)であった。EGCG の拡散係 数 Dobs はコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と混合することで、混 合溶液中のコレステロール-PC-MO-OA 含有胆汁酸ミセルの拡散係数 Dbound である 6.96 × 10−10 m2/s に近くなった(Fig. 3-2-2,Table 3-2-1) 。これは EGCG とコレステロ ール-PC-MO-OA 含有胆汁酸ミセル溶液を混合することで、EGCG とコレステロー ル-PC-MO-OA 含有胆汁酸ミセルとの複合体が形成され、見かけ上、ひとつの分子 となったためと考えられた。 以上のことから、DOSY による解析からも、EGCG はコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用していることが確認された。 60 Fig. 3-2-1 EGCG 単独の DOSY スペクトル 61 log(m2/s) 2 log (m /s) -9.4 -9.2 -9.0 胆汁酸ミセル 【7.30 × 10 -10 m 2 / s 】 7 6 5 4 3 -8.8 2 1 ppm Fig. 3-2-2 コレステロール-PC-MO-OA 含有胆汁酸ミセル単独の DOSY スペクト ル 62 Fig. 3-2-3 EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセルを混合した際の DOSY スペクトル 63 Table 3-2-1 DOSY スペクトルから解析した拡散係数 (× 10−10 m2/s) EGCG Chol-PC-MO-OA 胆汁酸ミセル溶液 Dfree Dobs Dmicelle Dbound 3.67 6.49 7.30 6.96 Dfree : EGCG 単独の拡散係数 Dobs : 混合溶液中の EGCG の拡散係数 Dmicelle : Chol-PC-MO-OA 胆汁酸ミセル単独の拡散係数 Dbound : 混合溶液中の Chol-PC-MO-OA 胆汁酸ミセルの拡散係数 64 第3章 第3節 カテキンと胆汁酸ミセルとの相互作用解析 1 H 縦緩和時間測定によるカテキンと胆汁酸ミセルとの相互作用解析 本章第 1 節および第 2 節より、EGCG はコレステロール-PC 含有胆汁酸ミセル およびコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用していることが確 認された。EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセルが相互作用し た際には、EGCG の分子運動に変化が起こることが予想される。 そのため、本節では、EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセル との相互作用をさらに調べるため、NMR による 1H 縦緩和時間 (T1)を測定し、 単独状態の EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と混合し た状態の EGCG との分子の運動性を比較することを目的とした。 実験方法 D2O と、NaD2PO4 を用い、コレステロール-PC-MO-OA 含有胆汁酸ミセル溶 液を調製した(実験 3-1-2 と同様)。EGCG の粉末を EGCG のモル濃度が 1 mM となるように、胆汁酸ミセル溶液に添加、混合し、NMR 測定用試料 600 l とし た。これに内部標準物質として 1 mg/mL DSS を 20 L 添加した。室温で 1 時間 静置後、混合物の T1 を NMR により測定した。 T1の測定条件は、以下の通りである。また、T1測定には反転回復 (inversion recovery) 法を用いた。 65 <NMR 測定パラメータ> Program name: t1ir Resonance frequency: 399.7 MHz Excitation pulse length: 14.0 s Value variations: 0.05, 0.1, 0.2, 0.4, 1.0, 2.0, 4.0, 8.0, 10.0, 20.0, 40.0 s Pulse delay time: 40.0 s Acquisition times: 0.01 (F1), 4.0 (F2) s Data points: 64 (F1), 65536 (F2) Window functions: EM (F1), SINE (F2) Spinning: 0 Hz Temperature: 300.0 K 結果 1 H 縦緩和時間 (T1)は分子の運動性に依存しており、通常の溶液系では、速い 運動をしている分子の T1 は長くなり、遅い運動をしている分子では T1 は短くな る。 Table 3-3-1 には EGCG 単独の場合とコレステロール-PC-MO-OA 含有胆汁酸ミ セル溶液を混合した場合の EGCG の T1 を示した。また、その際の EGCG の T1 変 化量 ΔT1 (EGCG 単独の T1 − コレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と 混合した際の EGCG の T1) を Fig. 3-3-1 に示した。 EGCG はコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と混合することで、 概して EGCG のプロトンの T1 は減少する傾向になった。これにより、EGCG はコレ ステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用することで、EGCG の分子 運動が制限され、単独状態とは異なる運動性を有していることが推定された。特に 66 EGCG の A 環 (8 位) およびガロイル基 (2′′/6′′) の T1 が大きく減少した。 以上のことから、T1 による解析結果からも、EGCG はコレステロール-PC-MO-OA 含 有胆汁酸ミセルと相互作用していることが確認された。しかしながら、帰属できた EGCG の全てのプロトンの T1 が減少しており、EGCG のどの部位がコレステロール -PC-MO-OA 含有胆汁酸ミセルと相互作用するのかは特定できなかった。 67 Table 3-3-1 EGCG 単独とコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と 混合した際の EGCG の 1H 縦緩和時間 T1 (s) Position 2′′/6′′ 2′/6′ 6 8 3 2 4* 4* T1 ± SD (n = 3) Free Complex 3.02 ± 0.57 1.58 ± 0.23 1.69 ± 1.10 3.30 ± 1.13 0.84 ± 0.07 0.89 ± 0.07 0.28 ± 0.01 0.31 ± 0.02 1.13 ± 0.03 0.99 ± 0.05 1.06 ± 0.95 1.10 ± 0.01 0.56 ± 0.09 0.80 ± 0.10 ―* ―* * コレステロール-PC-MO-OA 含有胆汁酸ミセル溶液由来のシグナルと重なっ たために帰属できなかった。 68 Fig. 3-3-1 コレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と混合した際の EGCG の 1H 縦緩和時間減少量 ΔT1 69 第3章 カテキンと胆汁酸ミセルとの相互作用解析 第4節 EGCG の胆汁酸ミセル中での局在位置の解析 本章第 1-3 節の結果より、EGCG はコレステロール-PC 含有胆汁酸ミセルおよ びコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用していることが確認さ れた。しかしながら、EGCG のどの部位が胆汁酸ミセルのどの成分と相互作用する のかは特定できなかった。胆汁酸ミセルは Fig. 3-4-1 に示すように表層が親水性、 内部が疎水性である。前節までに、EGCG とコレステロール-PC 含有胆汁酸ミ セルとの相互作用が明らかとなったため、EGCG のコレステロール-PC 胆含有 汁酸ミセルの局在している位置を明らかにすることを試みた。 実験方法 表層 (親水部)もしくは内部 (疎水性部)に蛍光プローブを組み込んだコレステ ロール-PC 含有胆汁酸ミセルを作製し、EGCG と混合し、EGCG がその蛍光を 消光する性質を利用することで 81) 、コレステロール-PC 含有胆汁酸ミセル中で の EGCG の局在位置を推定することを目的とした。蛍光プローブとして 2-(9-anthroyloxy) stearic acid (2-SA)および 12-(9-anthroyloxy) stearic acid (12-SA)を 用いた。なお、2-SA はカルボキシル基近傍 (親水性部)に蛍光発色団を持つため、 コレステロール-PC 胆含胆汁酸ミセル表層で蛍光を発し、一方で、12-SA は、カ ルボキシル基から離れた位置 (疎水性部)に蛍光発色団を持つため、コレステロ ール-PC 含有胆汁酸ミセルの内部で蛍光を発する。そのため、コレステロール -PC 含有胆汁酸ミセル溶液と混合した EGCG が、2-SA 由来の蛍光を消光すれば、 EGCG は表層 (親水性部)に存在し、12-SA 由来の蛍光を消光すれば、EGCG は 内部 (疎水性部)に存在すると考えることができる。 70 蛍光プローブを組み込んだChol-PC 胆汁酸ミセル溶液の組成 <2-SAを組み込んだコレステロール-PC含有胆汁酸ミセル溶液> (親水部) 0.5 mM Cholesterol 0.6 mM PC 1.0 mM 2-SA 6.6 mM Sodium taurocholate 132 mM Sodium chloride 15 mM Sodium phosphate (NaH2PO4) <12-SAを組み込んだコレステロール-PC含有胆汁酸ミセル溶液> (疎水性部) 0.5 mM Cholesterol 0.6 mM PC 1.0 mM 12-SA 6.6 mM Sodium taurocholate 132 mM Sodium chloride 15 mM Sodium phosphate (NaH2PO4) いずれも超音波処理により調製後、室温で1晩静置することで安定化させたのち 実験に用いた。 蛍光強度測定の試料調製 EGCG を PBS に溶解し、各モル濃度の EGCG 溶液を調製した。そして、96 穴 プレートにそれぞれの蛍光プローブを組み込んだコレステロール-PC 含有胆汁 酸ミセル溶液 100 l を分注し、各モル濃度の EGCG 溶液 100 l を分注した。コ レステロールが沈殿しないように 20 C、20 分間静置後、蛍光強度を測定した。 なお、2-SA の励起波長は 362 nm、蛍光波長は 446 nm、12-SA の励起波長は 381 nm、蛍光波長は 446 nm である。また、EGCG 溶液を加えていない場合 (モル濃 度: 0 mM) の蛍光強度を 100 %として表示した。蛍光強度測定には蛍光プレート リーダー (Molecular Devices 社製 Flex station II) を用いた。 71 統計解析 全ての結果は平均値 ± 標準誤差で標記した。統計検定は二元配置分散分析に より行い、有意差が見られた場合は Bonferroni/Dunn の多重比較検定で群間比較 を行い、P < 0.05 で有意差ありとした。 結果 EGCG と 2-SA もしくは 12-SA の蛍光プローブを組み込んだコレステロール -PC 含有胆汁酸ミセル溶液とを混合した際のそれぞれの蛍光強度を Fig. 3-4-2 に 示した。EGCG と蛍光プローブを組み込んだコレステロール-PC 含有胆汁酸ミセ ル溶液を混合した際の蛍光強度は、EGCG の濃度依存的に減少した。さらに、 2-SA と 12-SA の蛍光強度を比較すると、2-SA の蛍光強度の方が顕著に減少した。 これは、EGCG がコレステロール-PC 含有胆汁酸ミセルの表面にある 2-SA 由来 の蛍光を消光したことで、蛍光強度が下がったためと考えられる。 以上のことから、EGCG はコレステロール-PC 含有胆汁酸ミセルの親水性部に 局在していることが推定された。 72 Fig. 3-4-1 蛍光プローブを組み込んだ胆汁酸ミセルの模式図 73 Fig. 3-4-2 EGCG と蛍光プローブを組み込んだコレステロール-PC 含有胆汁酸ミ セル溶液を混合した際の蛍光強度の変化 Data are means ± SE of triplicate experiments. Means not sharing a common letter differ significantly (P < 0.05). Two-way ANOVA: effect of AS type, P < 0.0001; effect of EGCG concentration, P < 0.0001; interaction between AS type and EGCG concentration, P < 0.0001. 74 第3章 カテキンと胆汁酸ミセルとの相互作用解析 第5節 EGCG と胆汁酸ミセルとの NOE 解析 本章第 1-4 節までで、EGCG はコレステロール-PC 含有胆汁酸ミセルおよびコレ ステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用していることが示された。し かしながら、EGCG のどの部位が胆汁酸ミセルのどの成分と相互作用するのかは特 定できなかった。また、コレステロールが沈殿しない条件で検討を行ったところ、 EGCG はコレステロール-PC 含有胆汁酸ミセルの親水性部に局在していること が推定された。そこで、本節では、コレステロールが沈殿しない条件で EGCG と コレステロール-PC 含有胆汁酸ミセルが相互作用することによって、両者のどの 部分が接近しているのかを明らかにするため、NMR において相対的な距離情報 を見積もることができる NOESY (NOE-correlated spectroscopy) を測定すること にした。プロトン同士が 5 Å 以内の距離で存在している場合に NOE(nuclear Overhauser effect)が現れる 82)。NOE とはあるスピンと磁気的に相互作用してい る別のスピンの磁気共鳴の強度が変化する現象である。そのため、異なる分子 を混合した状態において、各分子間で NOE が検出された場合、それら分子は接 近していると考えることができる。 実験方法 D2O と、NaD2PO4 を用い、コレステロール-PC 含有胆汁酸ミセル溶液を調製 した(実験 3-1-1 と同様)。EGCG の粉末を EGCG のモル濃度が 1 mM となるよ うに、胆汁酸ミセル溶液に添加、混合した際に、EGCG のモル濃度が 0.5 mM(ほ とんど沈殿しない濃度)となるように、EGCG の粉末を量り取った。そして、 EGCG の粉末と D2O で調製したコレステロール-PC 含有胆汁酸ミセル溶液とを 75 混合し、NMR 測定用試料 1 ml とした。これに内部標準物質として 1 mg/ml DSS を 20 l 添加した。室温で 1 時間静置後、混合物の NOESY を測定した。 NOESYの測定条件は、以下の通りである。 <NMR 測定パラメータ> Program name: noesygpphpp Resonance frequency: 399.7 MHz Pulse delay time: 2.0 s Acquisition times: 0.03 (F1), 0.3 (F2) s Mixing time: 800 ms Data points: 1024 (F1), 1024 (F2) Window functions: QSINE (F1), QSINE (F2) Spinning: 0 Hz Temperature: 300.0 K 結果 EGCG とコレステロール-PC 含有胆汁酸ミセルとを混合した際の NOESY スペ クトルを Fig. 3-5-1 に示した。なお、Fig. 3-5-1 の一部を拡大したものを Fig. 3-5-2 に示した。 その結果、EGCG のガロイル基とコレステロール-PC 含有胆汁酸ミセルとの間 に分子間 NOE が検出された。そのうちの 1 つの 3.17 ppm のシングレットのプロ トンは、PC 二重層と EGCG の相互作用解析を行った文献値より PC のトリメチ ルアンモニウム基(位)であると考えられた 73)。リン脂質二重層 73)と同様に、胆 汁酸ミセルにおいても EGCG のガロイル基と PC のトリメチルアンモニウム基 との間に分子間 NOE が検出されたことから、EGCG とコレステロール-PC 含有 76 胆汁酸ミセルが相互作用する際には、EGCG のガロイル基と PC のトリメチルア ンモニウム基は 5 Å 以内の距離で接近していることが示された。このことから、 EGCG のガロイル基(電子を持つ)と PC のトリメチルアンモニウム基(カチ オンを持つ)が特異的相互作用(cation-相互作用)していることが推定された (Fig. 3-5-3)。PC のトリメチルアンモニウム基は親水性であることから、この 結果は、本章第四節の EGCG の親水性部での局在の結果を支持した。一方で、 EGCG とコレステロールの間に分子間 NOE は観察されなかった。また、コレス テロール-PC 含有胆汁酸ミセル溶液と混合することで、ガロイル基 (2′′/6′′) は多 くの位置で分子内 NOE が検出された(Fig. 3-5-1)。 77 2"/6" 2'/6' 分 子 内 NOE 分 子 間 NOE 68 NOESY スペクトル(全体図) Fig. 3-5-1 EGCG とコレステロール-PC 含有胆汁酸ミセルを混合した際の NOESY スペクトル 78 Fig. 3-5-2 EGCG とコレステロール-PC 含有胆汁酸ミセルを混合した際の NOESY スペクトル(Fig. 3-5-1 の一部を拡大したもの) 図中の四角は EGCG の 2′′/6′′ 位と PC のトリメチルアンモニウム基( 位) との分子間 NOE を示す。 79 Fig. 3-5-3 EGCG のガロイル基と PC のトリメチルアンモニウム基( 位)との cation-相互作用で接近した際のモデル図 灰色:炭素原子、赤:酸素原子、青:窒素原子、白:水素原子 ただし、EGCG と胆汁酸ミセルとの相互作用は、周囲の溶媒環境により変化 するため、示したモデル図は予想される相互作用状態の一場面である。 80 考察 本章では、EGCG が胆汁酸ミセルやその構成成分と相互作用するのかどうか、 各種 NMR 法を用いて検討を行った。 まず、コレステロール-PC 含有胆汁酸ミセルおよびコレステロール -PC-MO-OA 含有胆汁酸ミセルに EGCG を添加し、EGCG のプロトンのシグナ ルの変化を調べることで相互作用を解析した。ただし、EGCG の 4/4位のプロ トンのシグナルはどちらの胆汁酸ミセル由来のプロトンのシグナルとも重なっ てしまったために、解析できなかった。その結果、帰属できた全てのプロトン で化学シフトが変化した。これは、EGCG がコレステロール-PC 含有胆汁酸ミセ ルおよびコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用することによ り、EGCG の周囲の磁気的な環境が変化するためと考えられた。この磁気的な 環境の変化がそのプロトンの結合状態が変化したためなのか、他のプロトンの 結合状態が変化することで結合したもう一方の分子の結合部位以外の接近など により磁場に影響を受けたためなのかは判断できなかった。また、その際の化 学シフト変化量は、リン脂質二重層を用いた報告 72)と類似していた。さらに、 コレステロール-PC 含有胆汁酸ミセルでの化学シフト変化量(Fig. 3-1-2)はコレ ステロール-PC-MO-OA 含有胆汁酸ミセルでの化学シフト変化量(Fig. 3-1-4)と ほぼ一致していたことから、トリアシルグリセロール加水分解物である OA お よび MO は、EGCG と胆汁酸ミセルとの相互作用への関与は低いことが推定さ れた。これらのことから、EGCG はコレステロール-PC 含有胆汁酸ミセルおよび コレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用することが確認され (Fig. 3-1-2, Table 3-1-1, Fig. 3-1-3, Fig. 3-1-4, Table 3-1-2, and Fig. 3-1-5)、PC と相 81 互作用することが示唆された。 異なる分子は分子量や立体構造の違いなどにより、その分子特有の拡散係数を持 つことが知られている。そして、異なる分子同士が相互作用することにより、包接 複合体が形成され、 “見かけ上、ひとつの分子”となるため、それぞれの拡散係数が 近い値を示すことが報告されている 80)。そこで、異なる視点から EGCG とコレス テロール-PC-OA-MO 含有胆汁酸ミセルとの相互作用を確認するため、EGCG お よびコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液の拡散係数、また、EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液を混合した際のそれぞれの 拡散係数を NMR の測定法の 1 つである DOSY 法により測定することで、それら の拡散係数の変化を確認し相互作用を解析した。その結果、EGCG の拡散係数 Dobs はコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と混合することで、混合溶液 中のコレステロール-PC-MO-OA 含有胆汁酸ミセルの拡散係数 Dbound である 6.96 × 10−10 m2/s に近くなった(Fig. 3-2-1 and Table 3-2-1) 。このことから、EGCG とコレス テロール-PC-MO-OA 含有胆汁酸ミセルとの複合体が形成され、見かけ上、ひとつ の分子となったことが考えられた。このことはモノアシルグリセロールや遊離脂 肪酸が EGCG とコレステロールあるいは PC との相互作用に影響をあたえてお らず、コレステロールおよび PC の胆汁酸ミセル溶解性を維持させることによっ て、EGCG のコレステロールおよび PC の胆汁酸ミセル溶解性低減効果はほとん ど認められなかった要因であることを示唆した。この結果、DOSY 法による解析 でも EGCG はコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用することが 確認された。 EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセルが相互作用する際には、 EGCG の分子運動に変化が起こることが予想される。T1 は分子の運動性に依存 しており、通常の溶液系では、速い運動をしている分子の T1 は長くなり、遅い 82 運動をしている分子では T1 は短くなる 72)。そのため、相互作用に関与するプロ トンでの T1 変化が予想される。EGCG のどの部位がコレステロール-PC-MO-OA 含有胆汁酸ミセルとの相互作用に関与するかを特定すべく、NMR による T1 を測定 し、単独状態の EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と混 合した状態の EGCG との分子の運動性を比較した。その結果、EGCG はコレステ ロール-PC-MO-OA 含有胆汁酸ミセル溶液と混合することで、概して EGCG のプ ロトンの T1 は減少する傾向になった。これにより、EGCG はコレステロール -PC-MO-OA 含有胆汁酸ミセルと相互作用することで、EGCG の分子運動が制限 され、単独状態とは異なる運動性を有していることが推定された。特に EGCG の A 環 (8 位) およびガロイル基 (2′′/6′′) の T1 が大きく減少した。このことから、T1 測定にお いても EGCG はコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用するこ とが示された(Fig. 3-3-1 and Table 3-3-1) 。しかしながら、帰属できた EGCG の全 てのプロトンのT1 が減少しており、EGCG のどの部位がコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用するのかは特定できなかった。 1 H-NMR 測定、DOSY 解析および T1 測定の結果から、EGCG は胆汁酸ミセル中の PC と相互作用することが示唆されたことから、EGCG がコレステロール-PC 含有 胆汁酸ミセルのどこに局在しているか明らかにすることを試みた。EGCG と蛍 光プローブを組み込んだコレステロール-PC 含有胆汁酸ミセル溶液を混合した 際の 2-SA の蛍光強度が、EGCG の濃度依存的に減少した。これは、EGCG がコ レステロール-PC 含有胆汁酸ミセルの表面にある 2-SA 由来の蛍光を消光したこ とで、蛍光強度が下がったためだと考えられる。このことから、EGCG はコレ ステロール-PC 含有胆汁酸ミセルの親水性部に局在していることが推定された (Fig. 3-4-2)。なお、リン脂質二重層を用いた報告 72)でも EGCG はリン脂質二重 層の親水性部に局在しており、EGCG は胆汁酸ミセル中の PC の親水性部に局在す 83 ると考えられるコリンリン酸部分と相互作用することが示唆された。 相互作用する部位では、それらのプロトンは接近していると考えられる。プ ロトン同士が 5 Å 以内の距離で存在している場合に NOE が現れる 82)。NOE とは あるスピンと磁気的に相互作用している別のスピンの磁気共鳴の強度が変化す る現象である。そのため、異なる分子を混合した状態において、各分子間で NOE が検出された場合、それら分子は接近していると考えることができる。そこで、 コレステロールが沈殿しない条件で EGCG とコレステロール-PC 含有胆汁酸ミセ ルが相互作用することによって、両者のどの部分が接近しているのかを明らか にするため NOESY 測定を行った。その結果、EGCG のガロイル基とコレステロ ール-PC 含有胆汁酸ミセルとの間に分子間 NOE が検出された。そのうちの 1 つ の 3.17 ppm のシングレットのプロトンは、文献値より PC のトリメチルアンモ ニウム基 (位)であることが考えられた 72)。リン脂質二重層 72)と同様に、胆汁 酸ミセルにおいても EGCG のガロイル基と PC のトリメチルアンモニウム基と の間に分子間 NOE が検出されたことから、EGCG とコレステロール-PC 含有胆 汁酸ミセルが相互作用する際には、EGCG のガロイル基と PC のトリメチルアン モニウム基とは 5 Å 以内の距離で接近していることが示され、EGCG のガロイル 基と PC のトリメチルアンモニウム基が特異的相互作用(cation-相互作用)し ていることが推定された(Fig. 3-5-3)。PC のトリメチルアンモニウム基は親水 性であることから、この結果は、 本章第 4 節の EGCG の局在の結果を支持した。 第 2 章第 4 節では、PC, PA, PE, PI および PS ベシクルに EGCG を添加した際、 PC でのみその溶解性が低下することを示した。PC 以外の 4 種のリン脂質はそ れらの分子内にカチオンを持たない。これらのことから、EGCG のガロイル基 と PC のトリメチルアンモニウム基の特異的相互作用が PC の溶解性を低下させ ること、PC の胆汁酸ミセルとの親和性を強め、結果としてコレステロールの胆 84 汁酸ミセルとの親和性を強めることが推察された。 また、コレステロール-PC 含有胆汁酸ミセル溶液と混合することで、EGCG の ガロイル基 (2′′/6′′) のプロトンと B 環 (2′/6′) や A 環 (6, 8) のプロトンとのク ロスピークが観察され、分子内 NOE が検出された(Fig. 3-5-1)。これは、EGCG とコレステロール-PC 含有胆汁酸ミセルが相互作用することにより、EGCG 分子 のコンフォメーションに変化が起こり、分子内で接近するプロトンが増えたた めと推定された。これによって、1H-NMR による EGCG の各プロトンの化学シ フトの変化、T1 の減少が観察されたと考えられた。さらに Uekusa らの報告 73)と 同様に EGCG のガロイル基と B 環の間で分子内 NOE が観察されたことから (Fig. 3-5-1)、胆汁酸ミセル中でも EGCG がその分子内にて B 環およびガロイ ル基平面が-相互作用によってスタッキング構造をとること、この-相互作 用が EGCG と PC との cation-相互作用を増強する可能性が示唆された。 これらのことから、EGCG のガロイル基が、胆汁酸ミセル中の PC のトリメ チルアンモニウム基と特異的相互作用(cation-相互作用)していると推定され た。この cation-相互作用はアルカリ金属やアンモニウムイオンなどのカチオン と芳香環やアルケンなどの電子との間で働く非共有結合性的相互作用である 83) 。この cation-相互作用はタンパク質中において、カチオン性のアミノ酸残基 と芳香族アミノ酸残基との間に高い頻度で見いだされており、タンパク質の機 能発現への影響が報告されている 83-85)。 一方で、EGCG とコレステロールの間に分子間 NOE は観察されず、EGCG と コレステロールが直接相互作用するとは考えられなかった。しかしながら、コ レステロールと PC がリン脂質二重層中で 1:1 の化学量論比で相互作用してい るとの報告もある 86)。そのため、コレステロール-PC 複合体に EGCG がその複 合体中の PC と相互作用することで、コレステロール-PC-EGCG 複合体を形成 85 する可能性が考えられる。さらには、NOESY では NOE が観察されれば、その プロトン同士が空間的に近いと断言でき、その部位での相互作用を推定できる ものの、NOE が観察されないからといって、プロトン同士が空間的に遠いとは 断言できない測定方法である。各分子の各プロトン同士が非特異的に近い場合、 それぞれの NOE が弱くて見えない場合があるためである。弱い NOE を検出し ようとして混合時間(mixing time)を長くするとノイズが大きくなってしまう。 そのためその部位で相互作用していないだろうとはいえるが、相互作用してい ないと結論付けることはできない 82)。また、EGCG とコレステロールが非特異 的に疎水性相互作用する場合、各 NOE が弱く、観察されないこともありえる。 そのため、この結果からは EGCG とコレステロールはある部位同士で特異的に 相互作用していないと考えられるものの、非特異的にも相互作用していないか どうかは不明である。 従って、ガレート型カテキンが PC と特異的相互作用す ることでガレート型カテキンと PC およびコレステロールの 3 分子種の複合体 を形成するのかは明らかにできなかった。また、ガレート型カテキンとコレス テロールが直接相互作用しないことは証明できなかった。 そこで、次章では、表面プラズモン共鳴法を用い、各種カテキンと PC の分 子間相互作用解析を行うことで、カテキン種によって PC との結合・解離特性が 異なるかどうか、EGCG とコレステロールの分子間相互作用解析を行うことで、 EGCG とコレステロールが結合するかどうか検討を行った。 小括 1 H-NMR 測定により、EGCG がコレステロール-PC-MO-OA 含有胆汁酸ミセル と相互作用するかどうか、相互作用するならば EGCG のどの部位が相互作用に関与 86 しているのか検討した。EGCG はコレステロール-PC-MO-OA 含有胆汁酸ミセルと 相互作用することが確認された。しかしながら、EGCG のどの部位がこの胆汁酸ミ セルとの相互作用に関与するのかは特定できなかった。次に、DOSY 解析により EGCG がコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用するかどうか を拡散係数の点から検討した。その結果、EGCG の拡散係数 Dobs はコレステロール -PC-MO-OA 含有胆汁酸ミセル溶液と混合することで、混合溶液中のコレステロー ル-PC-MO-OA 含有胆汁酸ミセルの拡散係数 Dbound である 6.96 × 10−10 m2/s に近くな った。このことから、EGCG とコレステロール-PC-MO-OA 含有胆汁酸ミセルとの 複合体が形成され、見かけ上、ひとつの分子となったことが考えられた。さらに、 相互作用に関与するプロトンでの T1 変化が予想されたことから、T1 測定をおこ なった。その結果、EGCG はコレステロール-PC-MO-OA 含有胆汁酸ミセル溶液と 混合することで、帰属できた EGCG のプロトン全てにおいて T1 は減少した。これ により、EGCG はコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用するこ とで、EGCG の分子運動が制限され、単独状態とは異なる運動性を有していることが 推定され、T1 測定においても EGCG はコレステロール-PC-MO-OA 含有胆汁酸ミ セルと相互作用することが確認された。しかしながら、T1 測定においても EGCG の どの部位がこの胆汁酸ミセルとの相互作用に関与するのかは特定できなかった。 そこで、EGCG のコレステロール-PC 含有胆汁酸ミセル中での局在位置を検討 した。その結果、EGCG と蛍光プローブを組み込んだコレステロール-PC 含有胆 汁酸ミセル溶液を混合した際の 2-SA の蛍光強度が、EGCG の濃度依存的に減少 した。これは、EGCG がコレステロール-PC 含有胆汁酸ミセルの表面にある 2-SA 由来の蛍光を消光したことで、蛍光強度が下がったためと考えられる。これに より、EGCG はコレステロール-PC 含有胆汁酸ミセルの親水性部に局在している ことが推定された。相互作用する部位では、それらのプロトンは接近している 87 と考えられたため、NOESY 解析によりコレステロールが沈殿しない条件で EGCG とコレステロール-PC 含有胆汁酸ミセルが相互作用することによって、両者のど の部分が接近しているのかを明らかにすることを試みた。その結果、この胆汁 酸ミセル中において EGCG のガロイル基と PC のトリメチルアンモニウム基と の間に分子間 NOE が検出されたことから、EGCG のガロイル基と PC のトリメ チルアンモニウム基が特異的相互作用(cation-相互作用)すると推定された。 また、EGCG のガロイル基と B 環の間で分子内 NOE が観察されたことから、 この胆汁酸ミセル中でも EGCG がその分子内にて B 環およびガロイル基平面が -相互作用によってスタッキング構造をとること、この-相互作用が EGCG と PC との cation-相互作用を増強する可能性が示唆された。一方で、EGCG と コレステロールの間に分子間 NOE は観察されず、EGCG とコレステロールが直 接相互作用するとは考えられなかった。しかしながら、EGCG とコレステロー ルが非特異的にも相互作用していないかどうかは明らかに出来なかった。従っ て、ガレート型カテキンが PC と特異的相互作用することでガレート型カテキ ンと PC およびコレステロールの 3 分子種の複合体を形成するのかは明らかに できなかった。また、ガレート型カテキンとコレステロールが直接相互作用し ないことは証明できず、今後さらなる検討が必要と考えられた。 88 第4章 表面プラズモン共鳴法を用いた分子間相互作用解析 第1節 各種カテキンとホスファチジルコリンの分子間相互作用解析 第 3 章の結果から、EGCG のガロイル基が、胆汁酸ミセル中の PC の位と特 異的相互作用(cation-相互作用)することが推定された。一方で、EGCG とコ レステロールの間に分子間 NOE は観察されず、EGCG とコレステロールが直接 相互作用するとは考えられなかった。しかしながら、NOESY では特異的相互作 用の観察には非常に有用であるが、非特異的な相互作用の観察にはあまり適し ていない。従って、ガレート型カテキンが PC と特異的相互作用することでガ レート型カテキンと PC およびコレステロールの 3 分子種の複合体を形成する のかは明らかにできなかった。また、ガレート型カテキンとコレステロールが 直接相互作用しないことは証明できなかった。また、第 2 章第 2 節では、PC ベ シクルにガレート型カテキンである EGCG および GCG を添加した際、添加量 依存的に PC の溶解性が低下することを示した。一方で、遊離型カテキンである EGC 添加では、PC の溶解性低下作用はガレート型カテキンである EGCG およ び GCG と比較して有意に弱かった。そこで、本章では、この効果の違いが、各 カテキンと PC との結合・解離特性の違いによるものかどうか検討を行うため、 表面プラズモン共鳴法を用い、各種カテキンと PC の分子間相互作用解析を行っ た。さらに、リン脂質二重層にコレステロールを組み込み、EGCG とコレステ ロールの分子間相互作用解析を行うことで、EGCG とコレステロールが結合す るかどうか検討を行った。 試薬 実験に用いた試薬は以下の会社から購入した。なお、ここに記載以外の試薬は 第 2、3 章に記載のものと同じものを用いた。 89 「Sigma-Ardrich」 1-Palmitoyl-2-oleoylphosphatidylcholine (POPC) 、 1,2-Dioleoylphosphatidic acid (DOPA)、n-Octyl--glucopyranoside 「SRL」 1-Palmitoyl-2-oleoyl phosphatidic acid (POPA) 「和光純薬工業」 GC、ECG、CG、EC、C 「GE Healthcare」 センサーチップ L1、センサーチップ CM5、メンテナンスチップ、PBS-10×、 Regeneration Scouting Kit、BIAmaintenance Kit、HBS-EP Buffer 「バイエル」 Bovine serum albmin (BSA) 実験方法 表面プラズモン共鳴法(Surface Plasmon Resonance; SPR)の原理 金属表面に光(電磁波)を照射して表面プラズモン(金属中の電子が集まり、 波のように振動した状態)を強制的に振動させ共鳴させる。金属表面にぶつか った光は反射して屈折光となるが一部暗い部分が生じる。この暗い部分は金属 表面上に結合している分子の質量により角度が変化するという性質がある。そ の角度変化をリアルタイムに測定して分子の結合の量を RU (resonance unit, 1 RU = 1 pg/mm2 ) として検出する。つまり、センサーチップ表面に固定化した物 質に他の物質(アナライト)が結合すると 結合の量・速度が分かる(結合した ものを解離させると、解離の量・速度が分かる)すなわち、結合・解離速度定 数(カイネティクス解析)、結合・解離定数(アフィニティー解析)の算出が出 90 来る。 装置(東北大医学部共通機器室) Biacore X100 Plus package analytical system (GE Healthcare) にセンサーチップ L1 (GE Healthcare) を装着して測定温度 25°C にて実験を行った(User name: kobayashi, Password: 2000all)。なお、使用前後のメンテナンスはセンサーチップ CM5、メンテナンスチップ、BIAmaintenance Kit、HBS-EP Buffer を用い、取扱説 明書に従って実施した。 センサーチップ L1 の選択理由 リン脂質を固定化出来るセンサーチップには、センサーチップ HPA およびセ ンサーチップ L1 の 2 種類がある。センサーチップ HPA の特徴は、金膜全面に 直接長鎖アルキル鎖を導入していること、疎水表面を形成していること、疎水 吸着によりリン脂質一重層として固定化することである。一方、 センサーチッ プ L1 の特徴は、金膜上のデキストラン鎖のところどころにアルキル鎖を導入し ていること、部分的に疎水性が高い表面を形成していること、疎水吸着により リン脂質二重層として固定化することである。 後にコレステロールを組み込んだ試験も実施したいこと、コレステロールを 組み込むと、センサーチップ表面でのリポソーム同士の融合が起こり難くなり、 隙間が多くなることも想定されること、隙間がある場合、露出した疎水表面へ の非特異的吸着の影響が大きい等の理由から、センサーチップ全面が疎水基に 覆われているセンサーチップ HPA よりは、比較的疎水基の導入量が少ないセン サーチップ L1 を選択した。 91 リガンドおよびコントロールリガンド リガンド: 1-palmitoyl-2-oleoyl-PC (POPC), 相転移温度 (Tm); ─2 °C コントロールリガンド: センサーチップ表面の疎水領域を不活性化するために、 各種カテキンとほとんど相互作用しないと考えられたホスファチジン酸から、 1,2-dioleoyl-phosphatidic acid (DOPA) , Tm; ─8 °C を選択した。 固定化しやすいよう、固定化後の膜表面が固くならないよう、いずれも相転 移温度が測定温度(25°C)以下のものを Sigma-Aldrich 社より購入した。なお、 コントロールリガンド候補として、1-palmitoyl-2-oleoyl-phosphatidic acid (POPA) , Tm; 23 °C の固定化を試みたが、全く固定化できなかった。 リン脂質二重層の固定化 Subasinghe らの方法 87)に準じ、一部改変して行った。センサーチップ L1 の Reference flow cell に DOPA を、Measurement flow cell に POPC をリポソームとし て添加し、疎水性吸着を利用してそれぞれリン脂質二重層として固定化した。 「各リポソームの調製」 10 mM リン脂質となるように各リン脂質をガラス瓶にサンプリング(final volume 0.5 ml) ↓ N2 気流下で dry up ↓ ランニングバッファーである PBS(pH 6.8)「PBS-10×から調製」を 0.5 ml 添加し、 Vortex した。 ↓ 92 液体 N2 で凍結融解を 5 回繰り返す。 ↓ リポソーム調製器(Avanti Polar Lipids 社)に 0.5 m フィルターを装着し、フィ ルターを 19-20 回通過させた。 ↓ 使用時に 0.5 mM となるようにランニングバッファーPBS(pH 6.8) で希釈して 用いた。 POPC リポソーム固定化(測定用である Measurement flow cell) センサーチップ L1 を Biacore X100 Plus package analytical system に装着した。 ↓ センサーチップ洗浄試薬(40 mM n-octyl--glucopyranoside)を流速 10 l/min で 5 min 流した。 ↓ *流速を 5 l/min に切り替え、固定化量を揃えるため、「aim for immobilized level」コマンドで POPC リポソームを添加し、DOPA 固定化量になるべく揃え た。 ↓ 脂質コンディショニング試薬(10 mM NaOH)を 24 sec 流し、膜の均一化を行 った。 ↓ (固定化確認用 BSA 試薬 100 g/ml BSA を 2 min 流し、センサーチップのリン 脂質が固定化されていない間隙を埋める)しかし、BSA は EGCG と結合するの でこの操作は実施せず。 93 ↓ 1 mM EGCG in ランニングバッファーを添加前、添加後で RU が変わらなくな るまで流すことで解析時の非特異的結合を出来る限り抑制した。 ↓ Stand by 状態で一晩放置後(バッファーは流れており、リン脂質に結合した EGCG を落とす)、ベースラインが安定していることを確認後、カテキン添加実 験を開始した。 DOPA リポソーム固定化(対照用である Reference flow cell) POPC 固定化とほぼ同様。但し、上記*のところで、500 mM NaCl 含有ラン ニングバッファーで調製した DOPA リポソームを流すことを 2-3 回繰り返すと 標準固定化量付近まで固定化可能であった(DOPA は負に帯電しているため、セ ンサーチップ表面と反発しやすい。これを抑えるために 500 mM NaCl を加えた)。 固定化量結果 Reference flow cell(DOPA)の固定化量:5090.3 RU Measurement flow cell(POPC)の固定化量:5705.6 RU (DOPA の固定化量とな るべく揃えるため、「aim for immobilized level」コマンドで固定化量を調整した) アナライト 各種カテキン(EGCG, ECG, GCG, CG, EGC, EC, GC, and C)をランニングバッ ファーにて調製した。 94 SPR のシングルサイクルカイネティクス法 88)を用いた各種カテキンと PC との 分子間相互作用解析 SPR による分子間相互作用解析にはマルチサイクルカイネティクス法および シングルサイクルカイネティクス法がある。マルチサイクルカイネティクス法 では、あるアナライトを一濃度添加後、リガンドに結合したアナライトを完全 に解離させる「再生」溶液を毎回添加し、次の添加へと続いていく。しかしな がら、再生条件を GE Healthcare 推奨の再生試薬(Regeneration Scouting Kit)で 全て試してみたが、アナライトを完全に解離させることができなかった。また、 マルチサイクル法で設定できる流速、添加時間ではまだ直線的に RU 上昇が続い ている状態で解離条件に入ってしまった。そこで本実験では、再生操作が要ら ず、マルチサイクル法よりも流速を低く設定できることで添加時間を長く設定 でき、さらに同一アナライトを 5 濃度まで連続的に添加出来るシングルサイク ルカイネティクス法 88) を用い、各種カテキンと PC との分子間相互作用解析を 行った。 各濃度のカテキン溶液(ガレート型カテキン 0, 5, 10, 20, 40, 80 M、遊離型カ テキン 0, 50, 100, 200, 400, 800 M)をランニングバッファーで調整し、5 l/min で 1080 sec 流したのち(結合領域:結合をみるが、実際には一部で解離も起こ っているためみかけの結合をみている)、ランニングバッファーを 180 sec 流す (解離領域:純粋に解離のみ起こっている)。得られたセンサーグラムの結合お よび解離領域に対してカーブフィッティングをおこない、カイネティックス解 析により結合速度定数 Ka、解離速度定数 Kd、結合定数 KA と解離定数 KD を算出 する、あるいは平衡値解析により結合定数 KA と解離定数 KD を算出する。 95 結果 得られたセンサーグラムの一例(EGCG および EGC)を Fig. 4-1 に示した。 なお、示したセンサーグラムは、カテキン連続添加時の Measurement flow cell および Reference flow cell で得られたセンサーグラムから、ランニングバッファ ー連続添加時のセンサーグラムを差し引いた後、Measurement flow cell のセンサ ーグラムから Reference flow cell で得られたセンサーグラムを差し引いたセンサ ーグラムである。つまり、ダブルリファレンスを取ったセンサーグラムである。 どちらのカテキン添加でも、得られたセンサーグラムに対して「1:1 Binding モデル」 (リガンドとアナライトが一分子同士で結合するモデルで、反応モデル が分からない場合に用いる)でカーブフィッティングが良好でないこと、濃度 が違うとセンサーグラムの形状が異なること、反応が複雑で結合モデルが特定 できないことから、カイネティックス解析は断念した。さらに、予想と反して、 DOPA を固定化した Reference flow cell でも弱いながらもアナライト添加量依 存的に RU が上昇したことから(DOPA に非特異的に結合したのか、センサー チップのリン脂質が固定化されていない間隙に非特異的に結合したのかは判断 出来なかった)、みかけの解離定数 KD を Biacore X100 evaluation software を用い た平衡値解析 89)にて算出した。8 種類のカテキンの POPC に対するみかけの解 離定数 KD を Table 4-1 に示した。ガレート型カテキンは遊離型カテキンと比較 してみかけの解離定数が 1/10 以下と小さく、遊離型カテキンよりも強固に POPC と結合することが示された。 96 Fig. 4-1 シングルサイクルカイネティックス法によって得られたセンサーグラ ム A: EGCG, B: EGC 97 Table 4-1 シングルサイクルカイネティックス法によって得られたセンサーグラ ムから平衡値解析によって得られた各種カテキンの POPC に対するみかけの解 離定数 Apparent KD (M) EGCG 1.535 × 10−5 GCG 2.485 × 10−5 ECG 2.888 × 10−5 CG 3.662 × 10−5 EGC 6.685 × 10−4 GC 9.488 × 10−4 EC 1.036 × 10−3 C 4.316 × 10−4 98 第4章 表面プラズモン共鳴法を用いた分子間相互作用解析 第2節 EGCG とコレステロールの分子間相互作用解析 第 3 章の結果から、EGCG のガロイル基が、胆汁酸ミセル中の PC の位と特 異的相互作用(cation-相互作用)することが推定された。一方で、EGCG とコ レステロールの間に分子間 NOE は観察されず、EGCG とコレステロールが直接 相互作用するとは考えられなかった。しかしながら、NOESY では特異的相互作 用の観察には非常に有用であるが、非特異的な相互作用の観察にはあまり適し ていない。そこで、リン脂質二重層にコレステロールを組み込み、EGCG とコ レステロールの分子間相互作用解析を行うことで、EGCG とコレステロールが 結合するかどうか検討を行った。 実験方法 装置、使用したセンサーチップは第 1 節と同様である。 各リポソームの調製 10 mM リン脂質となるように各リン脂質(POPC あるいは DOPA)を、また、 0, 1, 3 mM コレステロールとなるようガラス瓶にサンプリング(final volume 0.5 ml) ↓ N2 気流下で溶媒を dry up した。 ↓ ランニングバッファーである PBS(pH 6.8)「GE Healthcare; BR-1006-72 から調製」 を 0.5 ml 添加し、Vortex した。 99 ↓ 液体 N2 で凍結融解を 5 回繰り返した。 ↓ リポソーム調製器(Avanti Polar Lipids 社)に 0.5 m フィルターを装着し、フィ ルターを 19-20 回通過させた。 ↓ 使用時に 0.5 mM リン脂質となるようにランニングバッファーPBS(pH 6.8) で 希釈して用いた。 POPC リポソーム固定化 センサーチップ L1 を Biacore X100 Plus package analytical system に装着した。 ↓ センサーチップ洗浄試薬(40 mM n-Octyl-- glucopyranoside)を流速 10 l/min で 5 min 流した。 ↓ *流速を 5 l/min に切り替え、POPC リポソームを 12 min 流す。 ↓ 膜にコレステロールがあるとアルカリ処理によって固定化量が落ちるため(実 際、固定化量が大きく低下した。この現象から確かにコレステロールがリン脂 質二重層に組み込まれていることが確認された)、脂質コンディショニング試薬 (10 mM NaOH)を流す操作はしなかった。 ↓ BSA は EGCG と結合するので固定化確認用 BSA 試薬 100 g/ml BSA を 2 min 流す操作は実施しなかった。 100 ↓ 流速を 30 l/min に上げ、ベースラインが安定するまで放置した。 ↓ 1 mM EGCG in ランニングバッファーを添加前、添加後で RU が変わらなくな るまで流すことで解析時の非特異的結合を出来る限り抑制した。 ↓ 流速を 30 l/min に上げ、ベースラインが安定するまで放置後、「Binding Analysis」コマンドによりカテキン添加実験を開始した。 DOPA リポソームの固定化 POPC 固定化とほぼ同様。但し、上記*のところで、500 mM NaCl 含有ラン ニングバッファーで調製した DOPA リポソームを流すことを 2-3 回繰り返すと 標準固定化量付近まで固定化可能(DOPA は負に帯電しているため、センサーチ ップ表面と反発しやすい。これを抑えるために 500 mM NaCl を加えた)。 固定化パターン コレステロールは水不溶性のため、リン脂質二重層に組み込んで固定化をす るべく以下の 4 つの固定化パターンを作成した。なお、コレステロールは固定 化の面からリン脂質の 30 % (mol/mol)までしか組み込めなかった。 1) Reference flow cell:0.5 mM POPC リポソーム、 Measurement flow cell:0.5 mM POPC + 0.05 mM コレステロールリポソーム 2) Reference flow cell:0.5 mM POPC リポソーム、 Measurement flow cell:0.5 mM POPC + 0.15 mM コレステロールリポソーム 3) Reference flow cell:0.5 mM DOPA リポソーム、 Measurement flow cell:0.5 mM DOPA + 0.05 mM コレステロールリポソーム 101 4) Reference flow cell(対照):0.5 mM DOPA リポソーム、 Measurement flow cell:0.5 mM DOPA + 0.15 mM コレステロールリポソーム 固定化量結果 1) Reference flow cell:8906.7 RU Measurement flow cell:8079.0 RU(理論上リン脂質固定化量は 7687.9 RU、理 論上コレステロール固定化量は 391.1 RU) 2) Reference flow cell:8277.0 RU Measurement flow cell:9261.7 RU(理論上リン脂質固定化量は 8035.4 RU、理 論上コレステロール固定化量は 1226.3 RU) 3) Reference flow cell:6766.2 RU Measurement flow cell:7812.6 RU(理論上リン脂質固定化量は 7416.0 RU、理 論上コレステロール固定化量は 396.6 RU) 4) Reference flow cell:6208.5 RU Measurement flow cell:9939.3 RU(理論上リン脂質固定化量は 8565.0 RU、理 論上コレステロール固定化量は 1374.3 RU) Binding Analysis 方法 Binding Analysis コマンドを用いて実施した。アナライトとして各濃度の EGCG 溶液をランニングバッファーで調製し、30 l/min で 60 sec 流した後(結合をみ る)、ランニングバッファーを 60 sec 流した(解離をみる)。リガンド(コレス テロール)とアナライト(EGCG)が相互作用するならば、アナライト添加時に レスポンスが上昇し、また、その上昇はアナライト添加濃度依存的である。結 合が認められれば、暫定的な KD 値を算出し、その 1/10~10 倍の濃度の EGCG 102 溶液でシングルカイネティクス法により正確な KD 値を算出する。 結果 各固定化パターンでのセンサーグラムを Fig. 4-2-1, 2, 3, and 4 に示した。なお、 示したセンサーグラムは、カテキン添加時の Measurement flow cell および Reference flow cell で得られたセンサーグラムから、ランニングバッファー連続 添加時のセンサーグラムを差し引いた後、Measurement flow cell のセンサーグラ ムから Reference flow cell で得られたセンサーグラムを差し引いたセンサーグラ ムである。つまり、ダブルリファレンスを取ったセンサーグラムである。 1) いずれの濃度でも EGCG 添加時のレスポンス上昇および EGCG 添加量依 存的なレスポンス上昇は認められず、むしろ EGCG 添加時の RU がベースラ インよりも低下した(Fig. 4-2-1)。これは、Reference flow cell の POPC 固定化 量:8906.7 RU に対し、Measurement flow cell の POPC 固定化量:7687.9 RU が小さく、POPC への結合量が小さいことが要因と考えられた。そこで、 Reference flow cell(POPC を固定化)および Measurement flow cell(POPC お よびコレステロールを固定化)単独のセンサーグラムをみると、どちらもア ナライト添加量依存的な速やかなレスポンスの上昇およびランニングバッ ファーに切り替えた際の速やかなレスポンスの下降がみられ、低分子同士の 相互作用に典型的な箱型のセンサーグラムであった(POPC に結合した) (data not shown)。従って、各濃度での EGCG 添加時の RU の差は(Fig. 4-2-1 の association と dissociation の間の差)、Reference flow cell と Measurement flow cell との POPC 固定化量の差が要因と考えられたものの、EGCG とコレステ ロールの結合による RU の変動がないとまでは断言できなかった。 2) コレステロール固定化量を 3 倍に増やしても、いずれの濃度でも EGCG 添 103 加時のレスポンス上昇および EGCG 添加量依存的なレスポンス上昇は認め られず、むしろ EGCG 添加時の RU がベースラインよりも低下した(Fig. 4-2-2)。これは、1) と同様の理由によると考えられた。そこで、Reference flow cell(POPC を固定化)および Measurement flow cell(POPC およびコレステロ ールを固定化)単独のセンサーグラムをみると、1) と同様に低分子同士の相 互作用に典型的な箱型のセンサーグラムであった(POPC に結合した)(data not shown)。従って、各濃度での EGCG 添加時の RU の差は、1) と同様に、 Reference flow cell と Measurement flow cell との POPC 固定化量の差が要因と 考えられたものの、EGCG とコレステロールの結合による RU の変動がない とまでは断言できなかった。 3) POPC よりも EGCG に結合しにくい DOPA で実施した。いずれの濃度でも EGCG 添加時のレスポンス上昇および EGCG 添加量依存的なレスポンス上 昇は認められず、むしろ EGCG 添加時の RU がベースラインよりも低下した (Fig. 4-2-3)。Measurement flow cell の DOPA 固定化量の方が、Reference flow cell の DOPA 固定化量よりも多いのに、EGCG 添加時の RU がベースラインより も 低 下 し た 要 因 の 特 定 は 出 来 な か っ た ( Reference flow cell お よ び Measurement flow cell 単独のセンサーグラムをみる限り、少なくともリン脂 質二重層が剥がれた形跡は認められなかった)。そこで、Reference flow cell (DOPA を固定化)および Measurement flow cell(DOPA およびコレステロー ルを固定化)単独のセンサーグラムをみると、どちらもアナライト添加量依 存的な速やかなレスポンスの上昇およびランニングバッファーに切り替え た際の速やかなレスポンスの下降がみられ、低分子同士の相互作用に典型的 な箱型のセンサーグラムであった(DOPA に結合した)(data not shown)。従 って、各濃度での EGCG 添加時の RU の差は(Fig. 4-2-3 の association と 104 dissociation の間の差)、Reference flow cell と Measurement flow cell との DOPA 固定化量の差が要因と考えられたものの、EGCG とコレステロールの 結合による RU の変動がないとまでは断言できなかった。 4) コレステロール固定化量を 3 倍に増やしても、いずれの濃度でも EGCG 添 加時のレスポンス上昇および EGCG 添加量依存的なレスポンス上昇は認め られず、むしろ EGCG 添加時の RU がベースラインよりも低下した(Fig. 4-2-4)。Measurement flow cell の DOPA 固定化量の方が、Reference flow cell の DOPA 固定化量よりも多いのに、EGCG 添加時の RU がベースラインよりも 低下した要因の特定は 3) と同様に出来なかった。そこで、Reference flow cell (DOPA を固定化)および Measurement flow cell(DOPA およびコレステロー ルを固定化)単独のセンサーグラムをみると、3) と同様に低分子同士の相互 作用に典型的な箱型のセンサーグラムであった(DOPA に結合した) (data not shown)。従って、各濃度での EGCG 添加時の RU の差は 3) と同様に、 Reference flow cell と Measurement flow cell との DOPA 固定化量の差が要因 と考えられたものの、EGCG とコレステロールの結合による RU の変動がな いとまでは断言できなかった。 1)~4) の結果から、EGCG とコレステロールが相互作用するとは考えられなか ったものの、EGCG とコレステロールが全く結合しないと結論づけることはで きなかった。 105 Fig.4-2-1 POPC 二重層にコレステロールを 10 %(mol/mol)組み込んだ際の Binding analysis 時のセンサーグラム Association; EGCG 添加開始、Dissociation; EGCG 添加終了 106 Fig.4-2-2 POPC 二重層にコレステロールを 30 %(mol/mol)組み込んだ際の Binding analysis 時のセンサーグラム Association; EGCG 添加開始、Dissociation; EGCG 添加終了 107 Fig.4-2-3 DOPA 二重層にコレステロールを 10 %(mol/mol)組み込んだ際の Binding analysis 時のセンサーグラム Association; EGCG 添加開始、Dissociation; EGCG 添加終了 108 Fig.4-2-4 DOPA 二重層にコレステロールを 30 %(mol/mol)組み込んだ際の Binding analysis 時のセンサーグラム Association; EGCG 添加開始、Dissociation; EGCG 添加終了 109 考察 本章では、第 1 節にてカテキン種によって PC との結合・解離特性が異なるか どうか分子間相互作用解析を行うことで検討を行った。また、第 2 節にて EGCG とコレステロールが結合するかどうか分子間相互作用解析を行うことで検討を 行った。 第 1 節では、再生が完全にできないこと、マルチサイクル法で設定できる流 速、添加時間ではまだ直線的にレスポンスの上昇が続いている状態で解離条件 に入ってしまうことから、マルチサイクル法よりも流速を低く設定でき、また、 添加時間を長く設定できるシングルサイクルカイネティックス法 88) によってセ ンサーグラムを得た。得られたセンサーグラムに対して「1:1 Binding モデル」 (リ ガンドとアナライトが一分子同士で結合するモデルで、反応モデルが分からな い場合に用いる)でカーブフィッティングが良好でないこと、濃度が違うとセ ンサーグラムの形状が異なる、反応が複雑で結合モデルが特定できないことか ら、カイネティックス解析は断念した。さらに、予想に反して DOPA を固定化 した Reference flow cell でも弱いながらもアナライト添加量依存的に RU が上 昇したことから(DOPA に非特異的に結合したのか、センサーチップのリン脂 質が固定化されていない間隙に非特異的に結合したのかは判断出来なかった)、 みかけの KD を Biacore X100 evaluation software を用いた平衡値解析にて算出する こととした。シングルサイクルカイネティックス法によって得られたセンサー グラムから平衡値解析 89)によって得られた各種カテキンの POPC に対するみか けの KD を算出した。ガレート型カテキンは遊離型カテキンと比較してみかけ の解離定数が 1/10 以下と小さく、遊離型カテキンよりも強固に POPC と結合し ていることが示された。なお、リン脂質(dimyristoylphosphatidylcholine)二重層 110 に各種カテキン(EGCG, ECG, EGC, and EC)を添加し、水晶振動子マイクロバ ランス法にて KD を算出した場合でも同様に、ガレート型カテキンのリン脂質二 重層との KD は遊離型カテキンのそれと比較して 1/10 以下と小さいことが報告 されている 90)。このガレート型カテキンと遊離型カテキンの PC との結合の強さ の違いが、ガレート型カテキンが遊離型カテキンよりも PC の溶解性低下作用 (第 2 章第 2 節)が強い要因であることが示唆された。また、第 2 章第 4 節に て EGCG は EGC には認められなかったコレステロールおよび PC の胆汁酸ミセ ルへの親和性を強める作用が示された。このコレステロールおよび PC の胆汁酸 ミセルへの親和性への影響も、ガレート型カテキンと遊離型カテキンの PC との 結合の強さの違いによることが示唆された。 第 2 節では、POPC および DOPA からなるリン脂質二重層にコレステロール を組み込み、EGCG とコレステロールの分子間相互作用解析を Binding analyses にて行った。しかしながら、全ての固定化パターンで EGCG 添加時のレスポン ス上昇および EGCG 添加量依存的なレスポンス上昇は認められなかった。なお、 全ての固定化パターンにおいて、Reference flow cell および Measurement flow cell 単独のセンサーグラムをみるとどちらセンサーグラムでもアナライト添加量依 存的な速やかなレスポンスの上昇およびランニングバッファーに切り替えた際 の速やかなレスポンスの下降がみられ、低分子同士の相互作用に典型的な箱型 のセンサーグラムであった(POPPC あるいは DOPA に結合した)(data not shown)。また、各濃度での EGCG 添加時の RU の差は(Fig. 4-2-1~4 の association と dissociation の間の差)、Reference flow cell と Measurement flow cell での POPC あるいは DOPA 固定化量の差が要因と考えられた。これらのことから、EGCG と コレステロールが相互作用するとは考えられなかったものの、EGCG とコレス テロールは結合しないと結論づけることはできなかった。そのため、ガレート 111 型カテキンがコレステロールと結合することによりコレステロールのミセル溶 解性を低下させることでコレステロール吸収を抑制するというこれまでの説 26, 27) を完全には否定できなかった。 SPR を用いた方法では、固定化の面から、コレステロールをリン脂質二重層 に組み込む選択肢しかなかった。また、コントロールリガンドとしてリン脂質 二重層を固定化する必要があった。本実験では予想に反してコントロールリガ ンドとして用いた DOPA にも EGCG が結合した。リガンドとコントロールリガ ンドの固定化量をきちんと揃えるのは非常に難しい。また、入手可能かつ相転 移温度が測定温度(25°C)以下のコントロールリガンドが DOPA のみであった ことから、コントロールリガンドを変更しての検討は出来なかった。そのため、 ガレート型カテキンがコレステロールと結合するかどうかは、コントロールリ ガンドを必要としない、水晶発振子マイクロバランス法にて検討する方がよい と考えられた。但し、水晶発振子マイクロバランス法では、センサー金膜表面 へのコレステロールの固定化の際、コレステロール分子唯一の官能基であるヒ ドロキシ基を利用して固定化せざるを得ない。そのため、ガレート型カテキン がコレステロールのヒドロキシ基を介して結合する場合は、この方法では不適 切という問題がある。 また、ガレート型カテキンと PC およびコレステロールの 3 分子種の複合体 を形成するのかは明らかにできなかった。 これまでの結果より、ガレート型カテキンがコレステロールではなく、PC と の特異的相互作用を介してコレステロール吸収を抑制する可能性が考えられた。 そこで、次章では、EGCG のコレステロール吸収抑制作用について培養細胞を 用い、コレステロールの取り込みへの影響について PC の有無の点からも検討 を行った。また、コレステロールを沈殿させない量の EGCG が実験動物におい 112 てコレステロール吸収抑制作用を発揮するかどうか検討を行った。 小括 カテキン種によって PC との結合・解離特性が異なるかどうか分子間相互作用 解析を行うことで検討を行った。シングルサイクルカイネティックス法によっ て得られたセンサーグラムから各種カテキンの POPC に対するみかけの KD を Biacore X100 evaluation software を用いた平衡値解析 89)にて算出した。その結果、 ガレート型カテキンは遊離型カテキンと比較してみかけの解離定数が 1/10 以下 と小さく、遊離型カテキンよりも強固に POPC と結合していることが示された。 このガレート型カテキンと遊離型カテキンの PC との結合の強さの違いが、ガレ ート型カテキンが遊離型カテキンよりも PC の溶解性低下作用が強い要因であ ることが示唆された。 さらに、NOESY では明らかにできなかった、EGCG と Chol が結合するかど うかについても表面プラズモン共鳴法を用い検討を行った。POPC および DOPA からなるリン脂質二重層にコレステロールを組み込み、EGCG とコレステロー ルの分子間相互作用解析を Binding analyses にて行ったが、全ての固定化パター ンで EGCG 添加時のレスポンス上昇および EGCG 添加量依存的なレスポンス 上昇は認められなかった。しかしながら、EGCG とコレステロールが結合しな いと結論づけることはできなかった。そのため、ガレート型カテキンがコレス テロールと結合することによりコレステロールのミセル溶解性を低下させるこ とでコレステロール吸収を抑制するというこれまでの説を完全には否定できな かった。また、ガレート型カテキンと PC およびコレステロールの 3 分子種の 複合体を形成するのかは明らかにできなかった。 113 第5章 カテキンのコレステロール吸収抑制作用 第1節 Caco-2 細胞へのコレステロール取り込みに及ぼす EGCG の影響 前章までの結果から、カテキンがコレステロール吸収抑制作用を発揮する要 因として、ガレート型カテキンが PC と特異的相互作用することで PC の溶解 性を低下させることでコレステロールの溶解性を低下させるのか、あるいは、 ガレート型カテキンとコレステロールおよび PC の 3 分子種の複合体を形成し て沈殿させるのかは明らかにできなかった。しかしながら、いずれにしても、 ガレート型カテキンと PC の特異的相互作用が、ガレート型カテキンのコレステ ロール吸収抑制作用を発揮するには重要である可能性が示唆された。そこで、 本章では EGCG のコレステロール吸収抑制作用について培養細胞を用い、コレ ステロールの取り込みへの影響について PC の有無の点からも検討を行った。 また、コレステロールを沈殿させない量の EGCG が実験動物においてコレステ ロール吸収抑制作用を発揮するかどうか検討を行った。 試薬 実験に用いた試薬は以下の会社から購入した。なお、ここに記載以外の試薬は 第 2~4 章に記載のものと同じものを用いた。 「Sigma-Ardrich」 Dulbecco’s Modified Eagle’s Medium - high glucose(DMEM)、 SDS、Insulin solution from bovine pancreas、Triton-X-100 「Gibco」 ペニシリン-ストレプトマイシン-グルタミン(100×)液体、ウシ胎 児血清(FBS) 「明治」Penicillin、Streptomycin 「MP Biochemicals」Non-essential amino acids for mem eagles(NEAA) 「Difco」Trypsin 250 114 「ニッスイ」PBS (-)(05913) 「同人堂」EDTA2Na 「PerkinElmer」[4-14C]-Cholesterol 「GE Healthcare」ULTIMA GOLD 実験方法 ヒト大腸癌由来の細胞株で分化することにより小腸上皮細胞のモデルとなる Caco-2 細胞を用いた in vitro の実験系においてトリアシルグリセロール加水分 解物を含有し生理的条件に近い胆汁酸ミセルにガレート型カテキンとして EGCG を沈殿が生じない濃度で添加した場合の Caco-2 細胞への放射性コレステ ロールの取り込みに及ぼす影響を検討する。また、胆汁酸ミセルに PC を含ま ない場合、含む場合でガレート型カテキンとして EGCG を沈殿が生じない濃度 で添加した場合の Caco-2 細胞への放射性コレステロールの取り込みに及ぼす影 響を検討する。本研究は東北大学の「放射性同位体実験室利用に関する指針」 にしたがって計画を策定し実施した。 実験 5-1-1:胆汁酸ミセルへの EGCG 2 mM 添加時の Caco-2 細胞への放射性コ レステロールの取り込みに及ぼす影響 培地調製 Caco-2 細胞の培養において、培地は Dulbecco’s Modified Eagle’s Medium - high glucose (500 ml) に Non-essential amino acids (5 ml)、ペニシリン-ストレプトマイ シン-グルタミン(100×)液体(5 ml)、Insulin solution(0.5 ml)、FBS(50 ml)を加え て穏やかに攪拌した。調製後は冷蔵庫に保存し、1 か月以内に使用した。 血清の非動化 115 ほ乳類の血清には補体が含まれているので、使う前に非動化する事によって 補体成分を不活化すると、細胞の増殖促進性が改善されることもある。 凍ったままの FBS(牛胎児血清、Gibco)をウオーターバスに入れ 56°C まで 温める。56°C になってから 30 分間インキュベートする。 DMEM:FBS=9:1 の比で混合する。 ☆使用の際には 0.5 % Trypsin 溶液の調製 Trypsin は、細胞を継代する際に用いる試薬である。 試薬:1. Trypsin; 1.0 g/200 mL 2. Penicillin; 2 万単位/200 mL {1 バイアル(=20 万単位)/2 mL-超純水} 3. streptomycin 20 mg/200 mL {1 バイアル(=1g)/5 mL-超純水} 4. 1M NaOH 5. 1M HCl ビーカー、三角フラスコ、メスフラスコは、あらかじめ超音波洗浄し、超純 水をかけておく。 ビーカーに超純水を入れ、そこに Trypsin を加える。 ↓ Penicillin を 0.2 mL 加える。 ↓ Streptomycin を 0.1 mL 加える。 ↓ 1M NaOH で pH を 8.0 にあわせる。 ↓ 116 4°C で一晩放置する。 ↓ 翌日、1 M HCl で pH を 7.2 にあわせる。 ↓ 超純水で 200 mL に fill up する。 ↓ 一度濾過して不純物を取り除く。 ↓ クリーンベンチ内で filter 滅菌する。 ↓ 使うときに PBS(-)+EDTA:Trypsin=1:1 の比で混合する。 「PBS(-) + 0.02 % EDTA 溶液の調整」 試薬:1. PBS(-)粉末 4.8 g 2. EDTA・2Na 0.1 g 超純水 500 mL に PBS(-)粉末 4.8 g と EDTA・2Na 0.1 g を溶解させる。 ↓ メディウム瓶に入れ、オートクレーブ滅菌(120°C、20 min)をする。 Caco-2 細胞培養法 1. 細胞融解法 細胞を普段使用してないときには、液体窒素中もしくは-85°C 冷凍庫で保存 している。その細胞を再び使用するときにおこなう。 117 液体窒素もしくは-85℃冷凍庫から、細胞のはいったチューブを取り出し 37°C のインキュベーターですばやく融解させる。 ↓ それを、クリーンベンチ内でスポイドで吸い取る。 ↓ 15 ml プラスチックチューブに入れる。 ↓ 10 倍量の培地を加える。 ↓ 激しく 20 回程度ピッペティングをする。 ↓ 100~110 × g で 1 分間遠心分離する。 ↓ 細胞が沈殿していることを確認後、上清を吸い取り、相当量の培地を加え、Dish に播種した。 2. 培地交換 Caco-2 細胞は接着細胞であるので、ここでは接着細胞の培地の交換の方法を記 す。 メディウムビンに DMEM を 9 に対し、FBS を 1 混合し、これを 37°C のインキ ュベーターで温める。温まったら、70 % エタノールで消毒して、クリーンベン チに入れる。インキュベーターから dish を取り出し、その古い培地を吸引除去 し、培地をゆっくり加える。6 cm dish の場合には 5 ml、10 cm dish の場合には 10 ml の培地を添加する。 118 Corning Costar 社のバイオコートセルカルチャー(Transwell-COL (コラーゲ ンコート済み)6well)では、クラスター(メンブレン下部)に 2.5 ml、トラン スウェル部(メンブレン上部)に 1.5 ml 添加する。 (バイオコートセルカルチャーの使用法) バイオコートセルカルチャーは 4°C で保存してあるので室温に戻す。 ↓ Apical site に 1.5 ml の培地を添加し 30 分間室温で放置する(クリーンベンチ内)。 ↓ Apical site の培地を吸い取りトリプシン処理を行った細胞+培地 1.5 ml を Apical site に添加する。 ↓ Basolateral site には培地を 2.5 ml 添加する。 培地の交換は、Apical site はそのまま培地を吸い取り、Basolateral site は横の隙 間から培地を吸い取る。そして、 Apical site にはそのまま培地を添加し、Basolateral site には横の隙間から培地を添加する。 3. 細胞継代法 古い培地を減圧吸引除去する。 ↓ 0.25 % Trypsin 溶液を 4 ml 添加する。 ↓ さらに 0.25 % Trypsin 溶液を 4 ml 添加し、その後 Trypsin を吸引除去する。 119 ↓ 37°C の CO2 インキュベーターで 7 分間反応させる。 ↓ 10 ml 培地(血清入り)を加え、反応を停止する。 ↓ 10 ml のガラスピペットを用いて泡立てないように Dish の底を洗う。 ↓ 浮遊液を 15 ml のチューブにとる。 ↓ 密栓後、100×g で 1 分間遠心し、細胞を沈殿させる。 ↓ 上清を吸引除去する。 ↓ 必要量の新しい培地を加えピペッティングで懸濁して、Dish に播く。 (必要があれば細胞数を計測する) 4. 細胞保存法 培養細胞を使って実験を行う場合、その条件や培養条件の一定した細胞が一 定に供給されることが望ましい。そのために細胞を凍結保存する必要がある。 FBS 入り DMEM に 10 % になるように DMSO(オートクレーブ滅菌済み)を 添加しておく。 上記の継代法に従い、細胞を剥離し遠心後、上清を除去し、保存用培地を 1.5 ml 加え、ピペッティングで撹拌する。(Caco-2 細胞の場合 10 cm Dish 一枚分) 120 ↓ それを岩城セラムチューブ(Cryogenic vial、2 ml)に取り氷冷する。 ↓ Nunc フリーズボックスにいれ、キムタオルを外周に巻いて-80°C のフリーザー に入れる。 ↓ 長期保存の場合、一晩放置の後、液体窒素に入れる。 「胆汁酸ミセルの調製」 Ikeda らの方法 75)に準じた胆汁酸ミセル組成で調製を行った(Table 5-1-1) 。 「添加実験」 コンフルエントに達した後、さらに 14 日間培養することで、微絨毛膜を充分 に形成させた Caco-2 細胞を実験に用いた。この Caco-2 細胞の Apical 側に培 地で作成した胆汁酸ミセル(Table 5-1-1)を 1.5 ml、Basolateral 側に培地を 2.5 ml 添加し、6 時間、37°C、5 % CO2 下でインキュベートした(n = 6)。Apical 側の 胆汁酸ミセル、Basolateral 側の培地は PBS で洗浄し、回収した(最終容量はそ れぞれ 3.5, 5.5 ml)。それぞれから 1 ml サンプリングを行い、シンチレーション カクテル(ULTIMA GOLD)を 10 ml 分注し、混和、一晩暗所で放置後、液体シ ンチレーションカウンター(LSC-5100, Aloka, Japan)にて放射活性を測定した。 細胞は 0.1 % Triton X-100 sol. 0.4 ml 添加後、セルスクレーパーにて剝ぎとり、 さらに 0.1 % Triton X-100 sol. 0.4 ml で 2 回、洗浄し、バイアルに回収した(計 1.2 ml)。37°C、30 min 保温し、超音波洗浄機にてバラバラにした。これにシン チレーションカクテルを 10 ml 分注し、混和、一晩暗所で放置後、液体シンチ 121 レーションカウンターにて放射活性を測定した。比活性、ろ過率などから、取 り込みおよび分泌されたコレステロール量を算出した。なお、回収率(「Apical + Basolateral + Cells」の放射活性/添加ミセルの放射活性)は EGCG 0 mM, 2 mM 群 ともそれぞれほぼ 100 % であった(data not shown)。 実験 5-1-2:PC の存在下および非存在下における胆汁酸ミセルへの EGCG 10 mM 添加時の Caco-2 細胞への放射性コレステロールの取り込みに及ぼす影響 「胆汁酸ミセルの調製」以外は実験 5-1-1 と同様に行った。 「胆汁酸ミセルの調製」 Ikeda らの方法 75)に準じた胆汁酸ミセル組成の調整を行った(Table 5-1-2) 。な お、回収率(「Apical + Basolateral + Cells」の放射活性/添加ミセルの放射活性) は全ての群でほぼ 100 % であった(data not shown)。 統計解析 全ての結果は平均値 ± 標準誤差で標記した。統計検定は一元配置分散分析あ るいは二元配置分散分析により行い、有意差が見られた場合は Bonferroni/Dunn の多重比較検定で群間比較を行い、P < 0.05 で有意差ありとした。 結果 実験 5-1-1:胆汁酸ミセルへの EGCG 2 mM 添加時の Caco-2 細胞への放射性コ レステロールの取り込みに及ぼす影響 122 コレステロールが沈澱しない条件である EGCG 2 mM 添加によるコレステロ ール取り込み抑制作用は認められなかった(Fig. 5-1-1) 。そこで、実験 5-1-2 に おいて EGCG 濃度を 10 mM まで上げて再度検討を行うこととした。 実験 5-1-2:PC の存在下および非存在下における胆汁酸ミセルへの EGCG 10 mM 添加時の Caco-2 細胞への放射性コレステロールの取り込みに及ぼす影響 EGCG 10 mM 添加(沈澱しない量)では PC の存在下および非存在下どちら でもコレステロールの取り込みの割合が EGCG 無添加の場合と比較して有意に 低下した(Fig. 5-1-2) 。また、このコレステロールの取り込みの割合の低下は PC を含まない胆汁酸ミセルでは減弱した(Fig. 5-1-2)。 また、PC (-) の Control では PC (+) の Control と比較して約 1.5 倍のコレステ ロール取り込み量であった。これは PC 自体がコレステロール吸収抑制効果(ミ セルからのコレステロールの放出抑制効果)を持っていること、PC が無いと細 胞膜保護効果が無く、単純拡散でコレステロールが取り込まれやすかったこと が考えられた。さらに、EGCG 10 mM 添加後の Caco-2 細胞が白くなっていた ため、細胞に影響したために、PC (-) でもコレステロールの取り込みが若干低 下した可能性が考えられた。 123 Table 5-1-1 胆汁酸ミセル組成 0.05 mM Cholesterol 3.7 kBq/dish 4-14C-Cholesterol 6.6 mM Sodium taurocholate 0.6 mM Egg yolk phosphatidylcholine 1 mM Oleic acid 0.5 mM 1-Monooleoylglycerol 0 or 2 mM EGCG High-glucose DMEM を添加後超音波処理にて作成後、220 nm フィルター滅菌。 この胆汁酸ミセルに 10 % 容となるように FBS を添加した。2 mM となるよう にサンプリングしておいた EGCG にこのミセルを加え混和した。 Table 5-1-2 胆汁酸ミセル組成 PC (-) 0.05 mM 2.22 kBq/dish 6.6 mM ─ 1 mM 0.5 mM Cholesterol 4-14C-Cholesterol Sodium taurocholate Egg yolk phosphatidylcholine Oleic acid 1-Monooleoylglycerol 0 or 10 mM EGCG( PC (+) 0.05 mM 2.22 kBq/dish 6.6 mM 0.6 mM 1 mM 0.5 mM High-glucose DMEM を添加後超音波処理にて作成後、220 nm フィルター滅菌。 この胆汁酸ミセルに 10 % 容となるように FBS を添加した。10 mM となるよう にサンプリングしておいた EGCG にこのミセルを加え混和した。 124 Fig. 5-1-1 EGCG 2 mM 添加時の放射性コレステロールの Caco-2 細胞への取り 込み量および Caco-2 細胞からの分泌量 Caco-2 cells were incubated for 6 hour. Data are means ± SE of 6 dishes. 125 Fig. 5-1-2 PC の存在下および非存在下における EGCG 10 mM 添加時の放射性 コレステロールの Caco-2 細胞への取り込み割合 Caco-2 cells were incubated for 6 hour. Data are means ± SE of 6 dishes. Means not sharing a common letter differ significantly (P < 0.05). Two-way ANOVA: effect of EGCG, P < 0.0001; effect of PC, P < 0.0001; interaction between EGCG and PC, P < 0.0001. 126 第5章 カテキンのコレステロール吸収抑制作用 第2節 膵胆管カニュレーション手術を施したラットにおけるミセル コレステロール吸収に及ぼす EGCG の影響 本章第 1 節にてコレステロールが沈澱しない条件(EGCG 10 mM)において、 Caco-2 細胞へのコレステロールの取り込みの割合が EGCG 無添加の場合と比 較して有意に低下した(Fig. 5-1-2)。そこで本節ではコレステロールが沈澱しな い条件(EGCG 10 mM)で EGCG が胆汁酸ミセルに溶解したコレステロールの 吸収に影響を与えるかどうか膵胆管カニュレーション手術を施したラットを用 いて検討をおこなった。 試薬 実験に用いた主な試薬は以下の会社から購入した。なお、ここに記載以外の 試薬は第 2~4 章および本章第 1 節に記載のものと同じものを用いた。 「和光純薬工業」 「共立製薬」 D-(+)-Glucose ソムノペンチル麻酔薬 実験方法 実験動物と飼料 実験動物は 8 週齢の SD 系雄ラット[日本クレア(株)東京]を購入した。飼育 条件は室温 25℃、12 時間(8:00~20:00)の明暗ライトサイクルとした。ラット 入荷後は 5 日間市販固形飼料(CE-2 日本クレア)を与え、水は自由摂取させ た。 127 膵胆管および胸管カニュレーション手術 Ikeda らの方法 75)に従ってラットに下記の手術を施した。体重 320~340 g の 9 週齢の SD 系雄ラットにソムノペンチル麻酔薬(0.08 ml/100g 体重)をかけた後、 胸管にカテーテル(SV35)[夏目製作所(株)東京]を挿入した。次に、膵胆管 にカテーテル(SP10)[夏目製作所(株)]を挿入した。十二指腸にはミセルを投 与するためのカテーテル(SP55)[夏目製作所(株)]を設置し固定した。この手 術により膵胆管からコレステロール吸収に関与する酵素を含む膵液と内因性コ レステロール・リン脂質を含む胆汁を体外に排出させた。手術後、体力が回復 するまで(手術日の 19:00)は、139 mM グルコース-85 mM NaCl 溶液を自由摂 取させ、その後は全く水分は与えなかった。その代り、手術後から実験終了ま では十二指腸に挿入したカテーテルから、3.4 ml/hour/rat となるように 0.05 mM コレステロール、0.6 mM L--ホスファチジルコリン、0.5 mM 1-モノオレイン、 1 mM オレイン酸、6.6 mM タウロコール酸ナトリウム、139 mM グルコース、 62 mM NaCl、15 mM リン酸二水素ナトリウム(pH 6.8)からなる胆汁酸ミセル を継続的に注入した(Table 5-2-1)。翌朝、小腸内にほとんどコレステロール吸 収に関与する酵素と内因性コレステロール・リン脂質がなくなったと考えられ るラットの十二指腸へ 37 kBq/rat となるように [4-14C] コレステロールを加え た試験胆汁酸ミセル(Table 5-2-2)を 2 ml 投与した。EGCG 添加群には 10 mM となるように EGCG をあらかじめ胆汁酸ミセル(Table 5-2-2)に加えた。ミセ ル中のコレステロールは小腸から吸収され胸管からリンパ液として回収される。 胆汁酸ミセル(Table 5-2-2)投与後、0~3、3~6、6~9 及び 9~24 時間のリン パ液を回収した。各フラクションのリンパ液 0.5 ml にシンチレーションカクテ ル(ULTIMA GOLD)を 10 ml 分注し、混和、一晩暗所で放置後、その放射活性 を液体シンチレーションカウンター(LSC-5100)により測定した。リンパ液は 128 抗凝固剤として 10 % EDTA 水溶液を加えたメスシリンダーに氷冷しながら回 収した。また、0~24 時間の胆汁も回収し、その放射活性を液体シンチレーシ ョンカウンターにより測定した。本研究は「東北大学における動物実験に関す る指針」および「放射性同位体実験室利用に関する指針」にしたがって計画を 策定し実施した。 統計解析 統計解析は Student’s t – test により P < 0.05 で有意差ありとした。 結果 投与前、投与後 6-9 時間の間に死亡した各 1 匹ずつ、投与 9-24 時間の間にリ ンパ液が詰まり回収できなかったラット 1 匹の計 3 匹のデータは削除した (Control 群, n = 4、EGCG 群, n = 5)。 アイソトープ含有胆汁酸ミセル投与後のリンパ流量はコントロール群で 37.6 ± 2.9 ml、EGCG 群で 38.3 ± 3.0 ml となり、群間で有意差は認められなかった(Fig. 5-2-1)。 胸管リンパへのコレステロールの回収率は EGCG 添加により、投与 3, 6, 9, 24 時間後のいずれにおいても有意に抑制された(Fig. 5-2-2)。 胆汁流量はコントロール群で 20.5 ± 1.0 ml、EGCG 群で 18.2 ± 2.2 ml となり、 群間で有意差は認められなかった(Fig. 5-2-3)。 胆汁へのコレステロールの回収率は EGCG 添加により有意に抑制された(Fig. 5-2-4)。 129 Table 5-2-1 持続注入胆汁酸ミセル組成(pH 6.8) 0.05 mM Cholesterol 0.6 mM Egg yolk phosphatidylcholine 1 mM Oleic acid 0.5 mM 1-Monooleoylglycerol 6.6 mM Sodium taurocholate 139 mM D-(+)-Glucose 62 mM NaCl 15 mM Sodium phosphate (NaH2PO4・2H2O) 超音波処理で作成。 Table 5-2-1 試験胆汁酸ミセル組成(pH 6.8) 0.05 mM Cholesterol 37 kBq/2 ml [4-14C] Cholesterol 0.6 mM Egg yolk phosphatidylcholine 1 mM Oleic acid 0.5 mM 1-Monooleoylglycerol 6.6 mM Sodium taurocholate 139 mM D-(+)-Glucose 62 mM NaCl 15 mM Sodium phosphate (NaH2PO4・2H2O) 0 or 10 mM EGCG 超音波処理で作成後、10 mM となるようにサンプリングしておいた EGCG にこ のミセルの一部を加え混和した。コントロールおよび EGCG 添加ミセルを 220 nm フィルターろ過したのち、十二指腸に挿入したカテーテルから 2 ml を投与 した。このミセルを持続投与ミセル 1 ml でカテーテル内に残らないように押し こんだ。 130 Fig. 5-2-1 Lymph flow of thoracic duct-cannulated rats drained of pancreatic juice and bile. Data are means ± SE of 4 or 5 rats. 131 Fig. 5-2-2 Lympatic recovery of micellar rats drained of pancreatic juice and bile. 14 C-cholesterol in thoracic duct-cannulated Data are means ± SE of 4 or 5 rats. Means not sharing a common letter at a time point significantly differ at P < 0.05. 132 25 20 15 10 5 0 Control EGCG Fig. 5-2-3 Bile flow of thoracic duct-cannulated rats drained of pancreatic juice and bile. Data are means ± SE of 4 or 5 rats. 133 Fig. 5-2-4 Biliary recovery of micellar drained of pancreatic juice and bile. 14 C-cholesterol in thoracic duct-cannulated rats Data are means ± SE of 4 or 5 rats. Means not sharing a common letter significantly differ at P < 0.05. 134 考察 本章では、第 5 章第 1 節にて Caco-2 細胞へのコレステロールの取り込みに及 ぼす EGCG の影響について検討を行った。また、第 2 節にて膵胆管カニュレー ション手術を施したラットにおけるミセルコレステロール吸収に及ぼす EGCG の影響について検討を行った。 第 1 節にて、ヒト大腸癌由来の細胞株で、分化することにより小腸上皮細胞 のモデルとなる Caco-2 細胞を用いた in vitro の実験系においてトリアシルグリ セロール加水分解物を含有し生理的条件に近い胆汁酸ミセルにガレート型カテ キンとして EGCG を沈殿が生じない濃度で添加した場合の Caco-2 細胞への放 射性コレステロールの取り込みに及ぼす影響について検討を行った。その結果、 コレステロールが沈澱しない条件である EGCG 2 mM 添加によるコレステロー ル取り込み抑制作用は認められなかった(Fig. 5-1-1)。そこで、実験 5-1-2 にお いて EGCG 濃度を 10 mM まで上げて再度検討を行った。またその際、コレス テロールの胆汁酸ミセル溶解量は総脂質濃度や胆汁酸種だけでなく、リン脂質 と胆汁酸の比率によって影響を受けることが in vitro 実験の結果から報告され ている 78)こと、本章第 2~4 章の結果からガレート型カテキンと PC の特異的相 互作用が、ガレート型カテキンのコレステロール吸収抑制作用を発揮するには 重要である可能性が示唆されたことから、PC の存在下および非存在下での検討 も同時に行った。その結果、EGCG 10 mM 添加(沈澱しない量)では PC の存 在下および非存在下どちらでもコレステロールの取り込みの割合が EGCG 無添 加の場合と比較して有意に低下した(Fig. 5-1-2)。また、このコレステロールの 取り込みの割合の低下は PC を含まない胆汁酸ミセルでは減弱したことから、 EGCG のコレステロール抑制作用に対する PC の関与が示唆された(Fig. 5-1-2)。 135 我々は通常リン脂質を 2~8 g/日程度摂取していること、胆汁中のリン脂質が 10 ~20 g/日程度消化管に流入しそのリン脂質のほとんどが PC であることから 79)、 消化管に流入するリン脂質の大半は PC であり、ガレート型カテキンは小腸内 腔で十分な作用を発揮しうると考えられる。 また、PC (-) の EGCG 無添加群では PC (+) の EGCG 無添加群と比較して約 1.5 倍のコレステロール取り込み量であった。これは PC 自体がコレステロール 吸収抑制効果(ミセルからのコレステロールの放出抑制効果)を持っているこ と 75)、PC が無いと細胞膜保護効果が無く、単純拡散でコレステロールが小腸上 皮細胞に取り込まれやすかったことが考えられた。さらに、EGCG 10 mM 添加 後の Caco-2 細胞表面が白くなっていたため、細胞に影響を与えたことで、PC (-) でもコレステロールの取り込みが若干低下した可能性が考えられた。そのため、 EGCG 5 mM 程度のより低濃度での検討が必要だと考えられた。さらには、胆汁 酸ミセル中のリン脂質種を変えて、PC 以外のリン脂質でもコレステロールの取 り込みが低下するかどうかの検討も必要と考えられた。 我々は、茶カテキンをコレステロールを含む脂質エマルジョンとともにラッ トに投与するとコレステロールの吸収が抑制されることを報告した 26, 27) 。脂質 エマルジョン中のコレステロールは生体内で胆汁酸ミセルに溶解した後吸収さ れるため、この 2 つの実験 26, 27)でもラット小腸内腔でコレステロールを沈殿さ せずともコレステロールの吸収を抑制した可能性が考えられた 26, 27)。そこで、 第 2 節では、コレステロールが沈澱しない条件(EGCG 10 mM)で EGCG が胆 汁酸ミセルに溶解したコレステロールの吸収に影響を与えるかどうか膵胆管カ ニュレーション手術を施したラットを用いて検討をおこなった。その結果、胸 管リンパへのコレステロールの回収率は EGCG 10 mM 添加により投与 3, 6, 9, 24 時間後のいずれにおいても有意に抑制された(Fig. 5-2-2)。このことから、EGCG 136 は胆汁酸ミセルからコレステロールを沈殿させなくともコレステロール吸収を 抑制する可能性が示唆された。しかしながら、コレステロールと比較してトリ アシルグリセロール加水分解物である脂肪酸やモノアシルグリセロールの吸収 は素早い 91)。そのため、生体内では胆汁酸ミセルの脂肪酸やモノアシルグリセ ロール濃度が低下していき、結果として、in vitro 実験で用いたコレステロール -PC 含有胆汁酸ミセルに近い組成となり、EGCG のガロイル基と PC のトリメチ ルアンモニウム基(位)との特異的相互作用(cation-相互作用)によってコ レステロールの胆汁酸ミセル溶解性が低下することでコレステロール吸収が抑 制された可能性も否定できない。Ikeda らは、ガレート型カテキン摂取ラットの 小腸内容物から胆汁酸ミセルを分画したところ、ガレート型カテキンを摂取し ていないラットの場合とミセルコレステロール濃度が同じであったことを示し たことから、コレステロールは沈殿していないことが示唆された(未発表デー タ)。このことからも、ガレート型カテキンは胆汁酸ミセルからコレステロール を沈殿除去しなくともガレート型カテキンのガロイル基と PC のトリメチルア ンモニウム基(位)との特異的相互作用(cation-相互作用)を介してコレス テロール吸収を抑制する可能性が示唆された。 一方で、今回の EGCG 添加量 10mM が多すぎた可能性も考えられた。そのた め、EGCG の添加量を 2 あるいは 5 mM まで落としての検討が必要と考えられ た。また、その際に PC を含有しないミセル群をいれておき、リン脂質吸収に 影響を及ぼすかどうかも検討する必要もあると考えられた。さらには、胆汁酸 ミセル中のリン脂質種を変えて、PC 以外のリン脂質でもコレステロールの吸収 が低下するかどうかの検討も必要と考えられた。 137 小括 小腸上皮細胞のモデルとなる Caco-2 細胞を用い、胆汁酸ミセルからコレステ ロールを沈殿させない量の EGCG を添加した場合の Caco-2 細胞への放射性コ レステロールの取り込みに及ぼす影響について検討を行った。その結果、コレ ステロールが沈澱しない条件である EGCG 2 mM 添加によるコレステロール取 り込み抑制作用は認められなかった。そこで、EGCG 濃度を 10 mM まで上げて 再度検討を行った。その際、PC の存在下および非存在下での検討も同時に行っ た。その結果、EGCG 10 mM 添加(沈澱しない量)では PC の存在下および非 存在下どちらでもコレステロールの取り込みの割合が EGCG 無添加の場合と比 較して有意に低下した。また、このコレステロールの取り込みの割合の低下は PC を含まない胆汁酸ミセルでは減弱したことから、EGCG のコレステロール 抑制作用に対する PC の関与が示唆された。 また、コレステロールが沈澱しない条件(EGCG 10 mM)で EGCG が胆汁酸 ミセルに溶解したコレステロールの吸収に影響を与えるかどうか膵胆管カニュ レーション手術を施したラットを用いて検討をおこなった。その結果、胸管リ ンパへのコレステロールの回収率は EGCG 10 mM 添加により投与 3, 6, 9, 24 時 間後のいずれにおいても有意に抑制された。このことから、ガレート型カテキ ンは胆汁酸ミセルからコレステロールを沈殿除去しなくとも、ガレート型カテ キンのガロイル基と PC のトリメチルアンモニウム基(位)との特異的相互作 用(cation-相互作用)を介してコレステロール吸収を抑制する可能性が示唆さ れた。 138 第6章 総括 本研究では、茶カテキンのコレステロール吸収抑制機構を解明するため、茶 カテキンの胆汁酸ミセルへのコレステロール溶解性低下作用機構に着目して検 討を行った。 消化管に流入した脂質はエマルジョン化された後、エマルジョン表層に胆汁 酸が作用し、ベシクルを経て胆汁酸ミセルが形成される 76) 。コレステロールが ヒト消化管から吸収されるには胆汁酸ミセルへの溶解が必須条件である 77) 。コ レステロールの胆汁酸ミセル溶解量は総脂質濃度や胆汁酸種だけでなく、リン 脂質と胆汁酸の比率によって影響を受けることが in vitro 実験の結果から報告 されている 78) 。これまで、ガレート型カテキンを胆汁酸ミセルに添加すると、 すみやかに白濁し沈殿を生じること、ガレート型カテキン添加量依存的にコレ ステロールの沈殿量が増加すること、沈殿物中の EGCG 量とコレステロールの 沈殿量が高い相関関係を示すことから 26) 、ガレート型カテキンがコレステロー ルと結合することによりコレステロールのミセル溶解性を低下させることでコ レステロール吸収を抑制すると考えられてきた。コレステロールは疎水性分子 のため、ガレート型カテキン分子内の疎水性領域と疎水性相互作用する可能性 が考えられるものの 70) 、どのようにしてガレート型カテキンが胆汁酸ミセル中 のコレステロールを沈殿させるのかはいまだ明らかにされていない。近年、ガ レート型カテキンのガロイル基とリン脂質との相互作用 ステロールの沈殿 70-73) が報告され、コレ 26, 27) と何らかの関係があると考えられるものの、この点に関 する情報はない。 まず、第 2 章ではコレステロールだけでなくリン脂質の胆汁酸ミセル溶解性 に及ぼすカテキン添加の影響を検討した。その結果、特にガレート型カテキン 139 がコレステロールだけでなく、PC の胆汁酸ミセル溶解性を低下させること (Fig.2-1-1)、PC 以外のリン脂質含有胆汁酸ミセルでは、EGCG のコレステロ ールおよびリン脂質の胆汁酸ミセル溶解性低減効果はほとんど認められないこ と(Fig.2-1-2)を明らかにした。このことは、カテキンがコレステロール吸収抑 制作用を発揮するには PC の存在が重要である可能性を示唆し、茶カテキンが コレステロールと結合することによりコレステロールのミセル溶解性を低下さ せることでコレステロール吸収を抑制するというこれまでの考えが正しくない 可能性を示唆した。すなわち、PC を沈殿させることでコレステロールの溶解性 を低下させる可能性、あるいは、ガレート型カテキンとコレステロールおよび PC の 3 分子種の複合体を形成して沈殿する可能性が考えられた。そこで、リン 脂質のみからなるベシクルを調製し、茶カテキンがリン脂質の溶解性を低下さ せるかどうか検討を行った。その結果、茶カテキンのうち特にガレート型カテ キンがリン脂質のなかでも特に PC のベシクル溶解性を低下させた(Fig. 2-2-1 and Fig. 2-2-2)。このことから、ガレート型カテキンが PC の溶解性を低下させる ことで、コレステロールの胆汁酸ミセル溶解性をも低下させる可能性が考えら れた。そこで、PC の溶解性の低下がコレステロールの胆汁酸ミセルへの溶解性 をどの程度低下させるのか、コレステロール-PC 含有胆汁酸ミセル中の PC 濃 度を変化させて調製し、その際のコレステロール溶解量について検討を行った。 その結果、PC 濃度と比例してのコレステロールの胆汁酸ミセルへの溶解量の低 下は認められず(Fig. 2-3-1)、胆汁酸ミセルからの PC の除去がコレステロール の溶解性の低下を引き起こすことは証明できなかった。しかし、この試験方法 は、すでにコレステロールが胆汁酸ミセルに溶解している状態から PC を除去 したわけではない。そのため、すでにコレステロールが胆汁酸ミセルに溶解し ているところから徐々に PC のみを除去できる試験系の確立を今後検討する必 140 要があると考えられた。 一方で、生理的条件に近いモノアシルグリセロールや遊離脂肪酸含有胆汁酸 ミセルでは、EGCG のコレステロールおよび PC の胆汁酸ミセル溶解性低減効果 はほとんど認められなかった(Fig.2-1-3)。この結果は茶カテキンが生体内でコ レステロールのミセル溶解性を低下させることでコレステロール吸収を抑制す るというこれまでの考えが正しくない可能性を示唆した。コレステロールの胆 汁酸ミセルへの親和性が強まると、コレステロールが胆汁酸ミセルから放出さ れにくく吸収されにくいことが報告されている 75)。また、コレステロールと PC の相互作用を示唆する報告がなされている 70-73) 。そこでコレステロールおよび PC の胆汁酸ミセルへの親和性に与える EGCG の影響について検討を行ったと ころ、EGCG はコレステロールおよび PC の胆汁酸ミセルへの親和性を強める 作用があることを示した(Fig. 2-4-1 and Fig. 2-4-2)。しかしながら、この試験方 法が生体内での現象を正確に反映するかどうかは不明であり、実際にカテキン がコレステロールの胆汁酸ミセルへの親和性を強めることでコレステロール吸 収抑制作用を発揮するかは明らかにできておらず、さらなる検討が必要と考え られた。これらの結果から、カテキンがコレステロール吸収抑制作用を発揮す るには PC の関与が示唆された。 そこで第 3 章では、EGCG が胆汁酸ミセルやその構成成分と相互作用するの かどうか、各種 NMR 法を用いて検討を行った。1H-NMR 測定、DOSY 解析およ び T1 による解析結果から、EGCG はコレステロール-PC-MO-OA 含有胆汁酸ミセル と相互作用していることが確認された(Fig. 3-1-2, Table 3-1-1, Fig. 3-1-3, Fig. 3-1-4, Table 3-1-2, Fig. 3-1-5, Fig. 3-3-1 and Table 3-3-1) 。しかしながら、EGCG のどの部位 がコレステロール-PC-MO-OA 含有胆汁酸ミセルと相互作用するのかは特定できな かった。 141 そこで、EGCG のコレステロール-PC 含有胆汁酸ミセル中での局在している位 置を明らかにすることを試みたところ、EGCG はコレステロール-PC 含有胆汁酸 ミセルの親水性部に局在していることが推定された(Fig. 3-4-2)。 そこで、コレステロールが沈殿しない条件で EGCG とコレステロール-PC 含有 胆汁酸ミセルが相互作用することによって、両者のどの部分が接近しているのか を明らかにするため NOESY 測定を行った。その結果、リン脂質二重層を用いた 報告と同様に、胆汁酸ミセルにおいても EGCG のガロイル基と PC のトリメチ ルアンモニウム基(位)との間に分子間 NOE が検出された(Fig. 3-5-1 and Fig. 3-5-2)。このことから、EGCG とコレステロール-PC 含有胆汁酸ミセルが相互作 用する際には、EGCG のガロイル基と PC のトリメチルアンモニウム基(位) とは 5 Å 以内の距離で接近していることが示され、両基が特異的相互作用 (cation-相互作用)していることが推定された(Fig. 3-5-3)。PC のトリメチル アンモニウム基は親水性であることから、この結果は、EGCG がコレステロー ル-PC 含有胆汁酸ミセルの親水性部に局在しているデータ(Fig. 3-4-2)を支持し た。一方で、EGCG とコレステロールの間に分子間 NOE は観察されず、EGCG とコレステロールが直接相互作用するとは考えられなかった。しかしながら、 コレステロールと PC がリン脂質二重層中で 1:1 の化学量論比で相互作用して いるとの報告もある 86)。そのため、コレステロール-PC 複合体に EGCG がその 複合体中の PC と相互作用することで、コレステロール-PC-EGCG 複合体を形 成し、沈殿する可能性が考えられる。しかしながら、NOESY は特異的相互作用 の観察には非常に有用であるが、非特異的な相互作用の観察にはあまり適して いない。そのため、NOESY では EGCG とコレステロールが非特異的に疎水性 相互作用する場合、各 NOE が弱く、観察されないこともありえる。そのため、 ガレート型カテキンが PC と特異的相互作用することで PC の溶解性を低下さ 142 せることでコレステロールの溶解性を低下させるのか、あるいは、ガレート型 カテキンと PC およびコレステロールの 3 分子種の複合体を形成するのかは明ら かにできなかった。 そこで第 4 章では、表面プラズモン共鳴法を用い、各種カテキンと PC の分子 間相互作用解析を行うことで、カテキン種によって PC との結合・解離特性が異 なるかどうか、EGCG とコレステロールの分子間相互作用解析を行うことで、 EGCG とコレステロールが結合するかどうか検討を行った。シングルサイクル カイネティックス法 88) によって得られたセンサーグラムから平衡値解析によっ て得られた各種カテキンの POPC に対するみかけの解離定数 KD を算出したと ころ、ガレート型カテキンは遊離型カテキンと比較してみかけの解離定数が 1/10 以下と小さく、遊離型カテキンよりも強固に POPC と結合していることが示唆 された(Table 4-1)。このガレート型カテキンと遊離型カテキンの PC との結合 の強さの違いが、ガレート型カテキンが遊離型カテキンよりも PC の溶解性低下 作用が強い要因であることが示唆された。また、EGCG は EGC には認められな かったコレステロールおよび PC の胆汁酸ミセルへの親和性を強める作用が第 2 章第 4 節で示されており、このコレステロールおよび PC の胆汁酸ミセルへの親 和性への影響も、ガレート型カテキンと遊離型カテキンの PC との結合の強さの 違いによることが示唆された。 また、NOESY では明らかにできなかった、EGCG とコレステロールが結合す るかどうかについても表面プラズモン共鳴法を用い検討を行った。POPC およ び DOPA からなるリン脂質二重層にコレステロールを組み込み、EGCG とコレ ステロールの分子間相互作用解析を Binding analyses にて行った。しかしながら、 全ての固定化パターンで EGCG 添加時のレスポンス上昇および EGCG 添加量 依存的なレスポンス上昇は認められなかった(Fig.4-2-1, Fig.4-2-2, Fig.4-2-3, and 143 Fig.4-2-4) 。これらのことから、EGCG とコレステロールが相互作用するとは考 えられなかったものの、EGCG とコレステロールは結合しないと結論づけるこ とはできなかった。EGCG とコレステロールが結合すると結論づけることはで きなかった。そのため、ガレート型カテキンがコレステロールと結合すること によりコレステロールのミセル溶解性を低下させることでコレステロール吸収 を抑制するというこれまでの説 26, 27) を完全には否定できなかった。また、ガレ ート型カテキンが PC と特異的相互作用することで PC の溶解性を低下させる ことでコレステロールの溶解性を低下させるのか、あるいは、ガレート型カテ キンとコレステロールおよび PC の 3 分子種の複合体を形成するのかは明らか にできなかった。 これまでの結果より、ガレート型カテキンがコレステロールではなく、PC と の特異的相互作用を介してコレステロール吸収を抑制する可能性が考えられた。 そこで、第 5 章では、EGCG のコレステロール吸収抑制作用について培養細胞 を用い、コレステロールの取り込みへの影響について PC の有無の点からも検 討を行った。また、コレステロールを沈殿させない量の EGCG が実験動物にお いてコレステロール吸収抑制作用を発揮するかどうか検討を行った。その結果、 EGCG 10 mM 添加(沈澱しない量)では PC の存在下および非存在下どちらで も小腸上皮細胞のモデルである Caco-2 細胞でのコレステロールの取り込みの割 合が EGCG 無添加の場合と比較して有意に低下した(Fig. 5-1-2)。また、この コレステロールの取り込みの割合の低下は PC を含まない胆汁酸ミセルでは減 弱し、PC の関与が示唆された(Fig. 5-1-2) 。 また、コレステロールが沈澱しない条件(EGCG 10 mM)で EGCG が胆汁酸 ミセルに溶解したコレステロールの吸収に影響を与えるかどうか膵胆管カニュ レーション手術を施したラットを用いて検討をおこなった。その結果、胸管リ 144 ンパへのコレステロールの回収率は EGCG 10 mM 添加により投与 3, 6, 9, 24 時 間後のいずれにおいても有意に抑制された(Fig. 5-2-2)。このことから、EGCG は 胆汁酸ミセルからコレステロールを沈殿させない条件でもコレステロール吸収 を抑制する可能性が示唆された。しかしながら、コレステロールと比較してト リアシルグリセロール加水分解物である脂肪酸やモノアシルグリセロールの吸 収は素早い 91)。そのため、生体内では胆汁酸ミセルの脂肪酸やモノアシルグリ セロール濃度が低下していき、結果として、in vitro 実験で用いたコレステロー ル-PC 含有胆汁酸ミセルに近い組成となり、結果として EGCG と PC との特異 的相互作用(cation-相互作用)によってコレステロールの胆汁酸ミセル溶解性 が低下することでコレステロール吸収が抑制された可能性も否定できない。 Ikeda らは、ガレート型カテキン摂取ラットの小腸内容物から胆汁酸ミセルを分 画したところ、ガレート型カテキンを摂取していないラットの場合とミセルコ レステロール濃度が同じであったことを示したことから、コレステロールは沈 殿していないことが示唆された(未発表データ)。このことからも、ガレート型 カテキンは胆汁酸ミセルからコレステロールを沈殿除去しなくともガレート型 カテキンのガロイル基と PC のトリメチルアンモニウム基(位)との特異的相 互作用(cation-相互作用)を介してコレステロール吸収を抑制する可能性が示 唆された。しかしながら、ガレート型カテキンのガロイル基と PC のトリメチル アンモニウム基(位)との特異的相互作用がどのような機構でコレステロール 吸収抑制作用を引き起こすのかは明らかにできなかった。 以上をまとめると、茶カテキンのうち特にガレート型カテキンがコレステロ ールではなく、PC との特異的相互作用を介してコレステロール吸収抑制作用を 発揮することが示唆された。消化管に流入するリン脂質の大半は PC であるこ とから 79) 、消化管内は、ガレート型カテキンがコレステロール吸収抑制作用を 145 発揮するのに適した環境であることが推察された。しかしながら、茶カテキン のコレステロール吸収抑制機構を完全には明らかにできておらず、今後さらな る検討が必要である。 146 参考文献 1) Subramanian, N.; Venkatesh, P.; Ganguli, S.; Sinkar, V.P. Role of polyphenol oxidase and peroxidase in the generation of black tea theaflavins. J. Agric. Food Chem. 1999, 47, 2571–2578. 2) Kobayashi, M.; Ikeda, I. Modulation of intestinal absorption of cholesterol by dietary polyphenols. POLYPHENOLS in Health and Disease: BOOK 1(Elsevier; edited by Watoson, R. R.; Preedy, V.; Zibadi, S.), 2014, chapter 48, 625-638. 3) 提坂裕子、小林誠, ポリフェノール: 薬用植物および食品の機能性成分(シ ーエムシー出版, 波多野力 編) 2012, 2, 181–199. 4) Chen, Z.-Y.; Xhu, Q. Y.; Tsang, D.; Huang, Y. Degradation of green tea catechins in tea drinks. J. Agric. Food Chem. 2001, 49, 477–482. 5) Seto, R.; Nakamura, H.; Nanjo, F.; Hara, Y. Preparation of epimers of tea catechins by heat treatment. Biosci. Biotechnol. Biochem. 1997, 61, 1434–1439. 6) 小林誠、鈴木裕子、野沢歩, ガレート型カテキンの血清コレステロール濃度 低下作用, 日本消化吸収学会誌「消化と吸収」2009, 32, 58–64. 7) Miura, Y.; Chiba, T.; Tomita, I.; Koizumi, H.; Miura, S.; Umegaki, K.; Hara, Y.; Ikeda, M.; Tomita, T. Tea catechins prevent the development of atherosclerosis in apoprotein E-deficient mice. J. Nutr.. 2001, 131, 27–32. 8) Murase, T.; Nagasawa, A.; Suzuki, J.; Hase, T.; Tokimitsu, I. Beneficial effects of tea catechins on diet-induced obesity: stimulation of lipid catabolism in the liver. Int. J. Obesity. 2000, 26, 1459–1464. 9) Ikeda, I.; Hamamoto, R.; Uzu, K.; Imaizumi, K.; Nagao, K.; Yanagita, T.; Suzuki, Y.; Kobayashi, M.; Kakuda, T. Dietary gallate esters of tea catechins reduce 147 deposition of visceral fat, hepatic triacylglycerol, and activities of hepatic enzymes related to fatty acid synthesis in rats. Biosci. Biotechnol. Biochem. 2005, 69, 1049–1053. 10) Kajimoto, O.; Kajimoto, Y.; Yabune, M.; Nakamura, T.; Kotani, K.; Suzuki, Y.; Nozawa, A.; Nagata, K.; Unno, T.; Sagesaka-Mitane, Y.; Kakuda, T.; Yoshikawa, T. Tea catechins with a galloyl moiety reduce body weight and fat. J. Healh Sci. 2005, 51, 161–171. 11) Okuda, T.; Kimura, Y.; Yoshida, T.; Hatano, T.; Okuda, H; Arichi, S. Studies on the activities of tannins and related compounds from medicinal plants and drugs. I. Inhibitory effects on lipid peroxidation in mitochondria and microsomes of liver. Chem. Pharm. Bull. 1983, 31, 1625–1631. 12) Yoshino, K.; Tomita, I.; Sano, M.; Oguni, I.; Hara, Y.; Nakano, M. Effects of long term dietary supplement of tea polyphenols on lipid peroxide levels in rats. Age 1994, 17, 79–85. 13) Kada, T.; Kaneko, K.; Matsuzaki, S.; Matsuzaki, T.; Hara, Y. Detection and chemical identification of natural bioantimutagens. A case of the green tea factor. Mutat. Res. 1985, 150, 127–132. 14) Fujiki, H.; Suganuma, M.; Okabe, S.; Sueoka, N.; Komori, A.; Sueoka, E.; Kozu, T.; Tada, Y.; Suga, K.; Imai, K.; Nakachi, K. Cancer inhibition by green tea. Mutat. Res. 1998, 402, 307–310. 15) Ikeda, I.; Tsuda, K.; Suzuki, Y.; Kobayashi, M.; Unno, T.; Tomoyori, H.; Goto, H.; Kawata, Y.; Imaizumi, K.; Nozawa, A.; Kakuda, T. Tea catechins with a galloyl moiety suppress postprandial hypertriacylglycerolemia by delaying lymphatic transport of dietary fat in rats. J. Nutr. 2005, 135, 155–159. 148 16) Chan, P. T.; Fong, W. P.; Cheung, Y. L.; Huang Y.; Ho, W. K. K.; Chen, Z. Y. Jasmine green tea epicatechins are hypolipidemic in hamsters (Mesocricetus auratus) fed a high fat diet. J. Nutr. 1999, 129, 1094–1101. 17) Imai, K.; Nakachi, K. Cross sectional study of effects of drinking green tea on cardiovascular and liver diseases. BMJ. 1995, 310, 693–696. 18) Kono, S.; Shinchi, K.; Ikeda, N.; Yanai, F.; Imanishi, K. Green tea consumption and serum lipid profiles: a cross-sectional study in northern kyushu, Japan. Prev med. 1992, 21, 526–531. 19) Kono, S.; Shinchi, K.; Wakabayashi, K.; Honjo, S.; Todoroki, I.; Sakurai, Y.; Imanishi, K.; Nishikawa, H.; Ogawa, S.; Katsurada, M. Relation of green tea consumption to serum lipids and lipoproteins in Japanese men. J Epidemiol. 1996, 6, 128–133. 20) Tokunaga, S.; White, I.R.; Tanaka, K.; Kono, S.; Tokudome, S.; Akamatsu, T.; Moriyama, T.; Zakouji, H. Green tea consumption and serum lipids and lipoproteins in a population of healthy workers in Japan. Ann Epidemiol, 2002, 12, 157–165. 21) Kajimoto, O.; Kajimoto, Y.; Yabune, M.; Nozawa, A.; Nagata, K.; Kakuda, T. Tea catechins reduce serum cholesterol levels in mild and borderline hypercholesterolemia patients. J. Clin. Biochem. 2003, 33, 101–111. 22) Kajimoto, O.; Kajimoto, Y.; Takeda, M.; Nozawa, A.; Suzuki, Y.; Kakuda, T. A beverage containing tea catechins with a galloyl moiety reduce serum cholesterol level in hypercholesterolemis womens. Health Sci. 2006, 22, 60–71. in Japanese with English summary. 23) Zheng, X. X.; Xu, Y. L.; Li, S. H.; Hui, R.; Huang, X. H. Green tea intake lowers serum total and LDL cholesterol in adults: a meta-analysis of 14 randomized 149 controlled trials. Am. J. Clin. Nutr. 2011, 94, 601–610. 24) Kim, A.; Chiu A.; Barone, M. K.; Avino, D.; Wang, F.; Coleman, C. I.; Phung, O. J. Green tea catechins decrease total and low-density lipoprotein cholesterol: a systematic review and meta-analysis. J. Am. Diet Assoc. 2011, 111, 1720–1729. 25) Koo, S.I, Noh, S.K. Green tea as inhibitor of the intestinal absorption of lipids: potential mechanism for its lipid-lowering effect. J Nutr Biochem, 2007, 8, 179–183. 26) Ikeda, I.; Imasato, Y.; Sasaki, E.; Nakayama, M.; Nagao, H.; Takeo, T.; Yayabe, F.; Sugano, M. Tea catechins decrease micellar solubility and intestinal absorption of cholesterol in rats. Biochim. Biophys. Acta 1992, 1127, 141–146. 27) Ikeda, I.; Kobayashi, M.; Hamada, T.; Tsuda, T.; Goto, H.; Imaizumi, K.; Nozawa, A.; Sugimoto, A; Kakuda, T. Heat-epimerized tea catechins rich in gallocatechin gallate and catechin gallate are more effective to inhibit cholesterol absorption than tea catechins rich in epigallocatechin gallate and epicatechin gallate. J. Agric. Food Chem. 2003, 51, 7303–7307. 28) Muramatsu, K.; Fukuyo, M.; Hara, Y. Effect of green tea catechins on plasma cholesterol level in cholesterol-fed rats. J. Nutr. Sci. Vitaminol. 1986, 32, 613–622. 29) Yang, T.T.C.; Koo, M.W.L. Chinese green tea lowers cholesterol level through an increase in fecal lipid excretion. Life Sci. 2000, 66, 411–423. 30) Kobayashi, M.; Unno, T.; Suzuki, Y.; Nozawa, A.; Sagesaka, Y.; Kakuda, T.; Ikeda, I. Heat-epimerized tea catechins have the same cholesterol-lowering activity as green tea catechins in cholesterol-fed rats. Biosci. Biotechnol. Biochem. 2005, 69, 2455–2458. 31) Raederstorff, D. G.; Schlachter, M. F.; Elste, V.; Weber, P. Effect of EGCG on lipid absorption and plasma lipid levels in rats. J. Nutr. Biochem. 2003, 14, 326–332. 150 32) Martin, M. J.; Browner, W. S.; Hulley, S. B.; Kuller, L.H.; Wentworth, D. Serum cholesterol, blood pressure and mortality: implications from a cohort of 361,662 men. Lanset, 1986, 2: 933–936. 33) Okamura, T.; Tanaka, H.; Miyamatsu, N.; Hayakawa, T.; Kadowaki, T.; Kita, Y.; Nakamura, Y.; Okayama, A.; Ueshima, H. NIPPON DATA80 Research Group. The relationship between serum total cholesterol and all-cause or cause-specific mortality in a 17.3-year study of a Japanese cohort. Atherosclerosis, 2007, 190, 216–23. 34) Jain, K. S.; Kathiravan, M. K.; Somani, R. S.; Shishoo, C. J. The biology and chemistry of hyperlipidemia. Bioorg Med Chem, 2007, 15, 4674–4699. 35) Tubobo, Y.; Tsugana, S. Green tea intake in relation to serum lipid level in middle-aged Japanese men and women. Ann Epidemiol. 1997, 7, 280–284. 36) Nagao T, Meguro S, Hase T, Otsuka K, Komikado M, Tokimitsu I, Yamamoto T, Yamamoto K. A catechin-rich beverage improves obesity and blood glucose control in patients with type 2 diabetes. Obesity (Silver Spring). 2009, 17, 310–317. 37) Nagao, T.; Komine, Y.; Soga, S.; Meguro, S.; Hase, T.; Tanaka, Y.; Tokimitsu, I. Ingestion of a tea rich in catechins leads to a reduction in body fat and malondialdehyde-modified LDL in men. Am J Clin Nutr. 2005, 81, 122–129. 38) Maki, K.C.; Reeves, M.S.; Farmer, M.; Yasunaga, K.; Matsuo, N.; Katsuragi, Y.; Komikado, M.; Tokimitsu, I.; Wilder, D.; Jones, F.; Blumberg, J. B.; Cartwright, Y. Green tea catechin consumption enhances exercise-induced abdominal fat loss in overweight and obese adults. J Nutr. 2009, 139, 264–270. 39) Nagao, T.; Hase, T.; Tokimitsu, I. A green tea extract high in catechins reduce body fat and cardiovascular risks in humans. Obesity (Silver Spring). 2007, 15, 1473–1483. 151 40) Princen, H. M.; van Duyvenvoorde, W.; Buytenhek, R.; Blonk, C.; Tijburg, L. B.; Langius, J. A.; Meinders, A. E.; Pijl, H. No effect of consumption of green and black tea on plasma lipid and antioxidant levels and on LDL oxidation in smokers. Arterioscler Thromb Vasc Biol. 1998, 18, 833–841. 41) Batista, Gde. A.; Cunha, C. L.; Scartezini, M.; von der Heyde, R.; Bitencourt, MG.; Melo, S. F. Prospective double-blind crossover study of Camellia sinensis (green tea) in dyslipidemias. Arq Bras Cadiol. 2009, 93, 128–134. 42) Frank, J.; George, T. W.; Lodge, J. K.; Rodriguez-Mateos, A. M.; Spencer, J. P.; Minihane, A. M.; Rimbach, G. Daily consumption of an aqueous green tea extract supplement does not impair liver function or alter cardiovascular disease risk biomarkers in healthy men. J Nutr. 2009, 139, 58–62. 43) Chan, C. C.; Koo, M. W.; Ng, E. H.; Tang, O. S.; Yeung, W. S.; Ho, P. C. Effects of Chinese green tea on weight, and hormonal and biochemical profiles in obese patients with polycystic ovary syndrome--a randomized placebo-controlled trial. J Soc Gynecol Investig. 2006, 13, 63–68. 44) Diepvens, K.; Kovacs, E. M.; Vogels, N.; Westerterp-Plantenga, M. S. Metabolic effects of green tea and of phases of weight loss. Physiol Behav. 2006, 87, 185–191. 45) Freese, R.; Basu, S.; Hietanen, E.; Nair, J.; Nakachi, K.; Bartsch, H.; Mutanen, M. Green tea extract decreases plasma malondialdehyde concentration but does not affect other indicators of oxidative stress, nitric oxide production, or hemostatic factors during a high-linoleic acid diet in healthy females. Eur J Nutr. 1999, 38, 149–157. 46) Fukino, Y.; Ikeda, A.; Maruyama, K.; Aoki, N.; Okubo, T.; Iso, H. Randomized controlled trial for an effect of green tea-extract powder supplementation on glucose abnormalities. Eur J Nutr. 2008, 62, 953–960. 152 47) Hsu, C. H.; Tsai, T. H.; Kao, Y. H.; Hwang, K. C.; Tseng, T. Y.; Chou, P. Effect of green tea extract on obese women: a randomized, double-blind, placebo-controlled clinical trial. Clin Nutr. 2008, 27, 363–370. 48) Nantz, M. P.; Rowe, C. A.; Bukowski, J. F.; Percival, S. S. Standardized capsule of Camellia sinensis lowers cardiovascular risk factors in a randomized, double-blind, placebo-controlled study. Nutrition. 2009, 25, 147–154. 49) Brown, A. L.; Lane, J.; Coverly, J.; Stocks, J.; Jackson, S.; Stephen, A.; Bluck, L.; Coward, A.; Hendrickx, H. Effects of dietary supplementation with the green tea polyphenol epigallocatechin-3-gallate on insulin resistance and associated metabolic risk factors: randomized controlled trial. Br J Nutr. 2009, 101, 886–894. 50) Maron, D. J.; Lu, G. P.; Cai, N. S.; Wu, Z. G.; Li, Y. H.; Chen, H.; Zhu, J. Q.; Jin, X. J.; Wouters, B. C.; Zhao, J. Cholesterol-lowering effect of a theaflavin-enriched green tea extract: a randomized controlled trial. Arch Intern med. 2003, 163, 1448–1453. 51) Di, Pierro. F.; Menghi, A. B.; Barreca, A.; Lucarelli, M.; Calandrelli, A. Greenselect phytosome as an adjunct to a low-calorie diet for treatment of obesity. Altern med Rev. 2009, 14, 154–160. 52) Eichenberger, P.; Colombani, P. C.; Mettler, S. Effects of 3-week consumption of green tea extracts on whole-body metabolism during cycling exercise in endurance-trained men. Int J Vitam Nutr Res. 2009, 79, 24–33. 53) Bertipaglia de Santana, M.; Mandarino, M. G.; Cardoso, J. R.; Dichi, I.; Dichi, J. B.; Camargo, A. E.; Fabris, B. A. Rodrigues, R. J.; Fatel, E. C.; Nixdorf, S. L.; Simão, A. N.; Cecchini, R.; Barbosa, D. S. Association between soy and green tea (Camellia sinensis) diminishes hypercholesterolemia and increases total plasma antioxidant potential in dyslipidemic subjects. Nutrition. 2008, 24, 562–568. 153 54) Matsuyama, T.; Tanaka, Y.; Kamimaki, I.; Nagao, T.; Tokimitsu, I. Catechin safely improved higher levels of fatness, blood pressure, and cholesterol in children. Obesity (Silver Spring). 2008, 16, 1338–1348. 55) Takeshita, M.; Takashima, S.; Harada, U.; Shibata, E.; Hosoya, N.; Takase, H.; Otsuka, K.; Meguro, S.; Komikado, M.; Tokikitsu, I. Effects of longterm consumption of tea catechins-enriched beverage with no caffeine on body composition in humans. Jpn Pharmacol Ther. 2008, 36, 767–776. In Japanese. 56) Inami, S.; Takano, M.; Yamamoto, M.; Murakami, D.; Tajika, K.; Yodogawa, K.; Yokoyama, S.; Ohno, N.; Ohba, T.; Sano, J.; Ibuki, C.; Seino, Y.; Mizuno, K. Tea catechin consumption reduces circulating oxidized low-density lipoprotein. Int Heart J. 2007, 48, 725–732. 57) Ryu, O. H.; Lee, J.; Lee, K. W.; Kim, H. Y.; Seo, J. A.; Kim, S. G.; Kim, N. H.; Baik, S. H.; Choi, D. S.; Choi, K. M. Effects of green tea consumption on inflammation, insulin resistance and pulse wave velocity in type 2 diabetes patients. Diabetes Res Clin Pract. 2006, 71, 356–358. 58) Erba, D.; Riso, P.; Bordoni, A.; Foti, P.; Biagi, P. L.; Testolin, G. Effectiveness of moderate green tea consumption on antioxidative status and plasma lipid profile in humans. J Nutr Biochem. 2005, 16, 144–149. 59) van het Hof, K.H.; de Boer, H. S.; Wiseman, S. A.; Lien, N.; Westrate, J. A.; Tijburg, L. B. Consumption of green or black tea does not increase resistance of low-density lipoprotein to oxidation in humans. Am J Clin Nutr. 1997, 66, 1125–1132. 60) Kuriyama, S., Shimizu, T., Ohmori, K., Kikuchi, N.; Nakaya, N.; Nishino, T.; Tsubono, Y.; Tsuji, I. Green tea consumption and mortality due to cardiovascular disease, cancer, and all causes in Japan : the ohsaki study. JAMA. 2006, 296, 1255-1265. 154 61) Muramatsu, K.; Fukuyo, M.; and Hara, Y. Effect of green tea catechins on plasma cholesterol level in cholesterol-fed rats. J. Nutr. Sci. Vitaminol. 1986, 32, 613-622. 62) Fukuyo, M.; Hara ,Y.; Muramatsu, K. Effect of leaf catechin, (-)-epigallocatechin gallate, on plasma cholesterol level in rats. J Jpn Soc Nutr Food Sci. 1986, 39, 495–500. in Japanese with English summary. 63) Matsuda, H.; Chisaka, T.; Kubomura, Y.; Yamahara, J.; Sawada, T.; Fujimura, H.; Kimura, H.Effects of crude drugs on experimental hypercholesterolemia. I. Tea and its active principles. J Ethnopharmacol. 1986, 17, 213–224. 64) Chan, P. T.; Fong, W. P.; Cheung, Y. L.; Huang, Y,.; Ho, W. K.; Chen, Z. Y. Jasmine green tea epicatechins are hypolipidemic in hamsters (Mesocricetus auratus) fed a high fat diet. J Nutr. 1999, 129, 1094–1101. 65) Bose, M.; Lambert, J. D.; Ju, J.; Reuhl, K. R.; Shapses, S. A.; Yang, C. S. The major green tea polyphenol, (-)-epigallocatechin-3-gallate, inhibits obesity, metabolic syndrome, and fatty liver disease in high-fat-fed mice. J Nutr. 2008, 138, 1677–1683. 66) Nakamura, Y.; Kaihara, A.; Yoshii, K.; Tsumura, Y.; Ishimitsu, S.; Tonogai, Y. Effects of the oral administration of green tea polyphenol and tannic acid on serum and hepatic lipid contents and fecal steroid excretion in rats. J Health Sci. 2001, 47, 107–117. 67) Yang, T. T.; Koo, M. W. Chinese green tea lowers cholesterol level through an increase in fecal lipid excretion. Life Sci. 2000, 66, 411–423. 68) Chisaka, T.; Matsuda, H.; Kubomura, Y.; Mochizuki, M.; Yamahara, J.; Fujimura, H. The effect of crude drugs on experimental hypercholesterolemia: mode of action of (–)-epigallocatechin gallate in tea leaves. Chem Pharm Bull (Tokyo). 1988, 36, 227–233. 155 69) Vermeer, M. A.; Mulder, T. P.; Molhuizen, H. O. Theaflavins from black tea, especially theaflavin-3-gallate, reduce the incorporation of cholesterol into mixed micelles. J. Agric. Food Chem. 2008, 56, 12031-12036. 70) Kajiya, K.; Kumazawa, S.; Nakayama, T. Steric effects of interaction of tea catechins with lipid bilayers. Biosci. Biotechnol. Biochem. 2001, 65, 2638–2643. 71) Kumazawa, S.; Kajiya, K.; Naito, A.; Saito, H.; Tuzi, S.; Tanio, M.; Suzuki, M.; Nanjo, F.; Suzuki, E.; Nakayama, T. Direct evidence of interaction of a green tea polyohenol, epigallocatechin gallate, with lipid bilayers by solid-state nuclear magnetic resonance. Biosci. Biotechnol. Biochem. 2004, 68, 1743–1747. 72) Uekusa, Y.; Kamihira, M.; Nakayama, T. Dynamic behavior of tea catechins interacting lipid membranes as determined by NMR spectroscopy. J. Agric. Food Chem. 2007, 55, 9986–9992. 73) Uekusa, Y.; Kamihira-Ishijima, M.; Sugimoto, O.; Ishii, T.; Kumazawa, S.; Nakamura, K.; Tanji, K.; Naito, A.; Nakayama, T. Interaction of epicatechin gallate with phospholipid membranes as revealed by solid-state NMR spectroscopy. Biochim. Biophys. Acta 2011, 1808, 1654–1660. 74) Bartlett, G. R. Phosphorus assay in column chromatograph. J. Biol. Chem. 1959, 234, 466–468. 75) Ikeda, I.; Matsuoka, K.; Hamada, T.; Mitsuii, K.; Imabayashi, S.; Uchino, A.; Sato, M.; Kuwano, E.; Itamara, T.; Yamada, K.; Tanaka, K.; Imaizumi, K. Cholesterol esterase accelerates intestinal cholesterol absorption. Biochim. Biophys. Acta. 2002, 1571, 34–44. 76) 今泉勝己、佐藤匡央, エンス(学文社, 吉田勉 脂質の消化・吸収・輸送 編)1998, 3, 812–818. 156 栄養と健康のライフサイ 77) Woollett, L. A.; Wang, Y.; Buckley, D. D.; Yao, L.; Chin, S.; Granholm, N.; Jones, P. J.; Setchell, K. D.; Tso, P.; Heubi, J. E. Micellar solubilisation of cholesterol is essential for absorption in humans. Gut. 2006, 55, 197–204. 78) Carey, M. C. Aqueous bile salt-lecithin-cholesterol systems: equilibrium aspects. Hepatology. 1984, 5, 151S–154S. 79) Cohn, J. S.; Kamili, A.; Wat, E.; Chung, RW.; Tandy S. Dietary phospholipids and intestinal cholesterol absorption. Nutrients. 2010, 2, 116–127. 80) 橋本康博, 堀池則子: DOSY NMR 法の展開 包接現象を評価する. 化学と生 物 2009, 47, 578583. 81) Kitano, K.; Nam, K. Y.; Kimura, S.; Fujiki, H.; Imanishi, Y. Sealing effect of (─)-epigallocatechin gallate on protein kinase C and protein phosphatase 2A. Biophys. Chem. 1997, 65, 157–164. 82) Lee, S.; Kim, Y. Solution structure of neuromedin B by 1H nuclear magnetic resonance spectroscopy. FEBS Lett. 1999, 460, 263–269. 83) Ma, J.; Doughey, D. The cation-interaction. Chem. Rev. 1997, 97, 1303–1324. 84) Johnson, R. M.; Hecht, K.; Deber, C. M. Aromatic and cation-interactions enhance helix-helix association in a membrane environment. Biochemistry. 2007, 46, 9208–9214. 85) Hagiwara, Y.; Matsumura, H.; Tateno, M. Functional roles of a structural element involving Na+-interactions in the catalytic site of T1 lipase revealed by molecular dynamics simulation. J. Am. Chem. Soc. 2009, 131, 16697–16705. 86) Hénin, J.; Chipot, C. Hydrogen-bonding patterns of cholesterol in lipid membranes. Chem. Phys. Lett. 2006, 425, 329–335. 87) Subasinghe, S.; Unabia, S.; Barrow, C. J.; Mok, S. S.; Aguilar, M. I.; Small, D. H. 157 Cholesterol is necessary both for the toxic effect of A peptides on vascular smooth muscle cells and Abinding to vascular smooth muscle cell membranes. J. Neurochem. 2003, 84, 471–479. 88) Karlsson, R.; Katsamba, P. S.; Nordin, H.; Pol, E.; Myszka, D. Analyzing a kinetic titration series using affinity biosensors. Anal. Biochem. 2006, 34, 136–147. 89) O’Shannessy, D. J.; Winzor, D. J. Interpretation of deviations from pseudo-first-order kinetic behavior in the characterization of ligand binding by biosensor technology. Anal Biochem. 1996, 236, 275–283. 90) Kamihira, M.; Nakazawa, H.; Kira, A.; Mizutani, Y.; Nakamura, M.; Nakayama, T. Interaction of tea catechins with lipid bilayers investigated by a quarts-crystal microbalance analysis. Biosci. Biotechnol. Biochem. 2008, 72, 1372–1375. 91) Ikeda, I.; Yamahira, T,; Kato, M,; Ayako, Ishikawa. Black-tea polyphenols decrease micellar solubility of cholesterol in vitro and intestinal absorption in rats. J. Agric. Food Chem. 2010, 58, 15, 8591-8595. 158 謝辞 本研究を行うにあたり、御懇篤なる御指導を賜った東北大学大学院農学研究 科、池田郁男教授に深甚の謝意を表します。 本研究の論文審査委員(副査)を御担当して頂いた東北大学大学院農学研究 科、齋藤忠夫教授、山下まり教授に厚く御礼を申し上げます。 御鞭撻、御助言を頂いた東北大学大学院農学研究科、都築毅准教授および井 上奈穂助教に厚く御礼を申し上げます。 NMR 測定および解析に御協力くださった静岡県立大学大学院薬食生命科学 総合学府、熊澤茂則教授、細谷孝博助教、西澤正人氏および中山勉教授(現 日 本獣医生命科学大学大学院)に厚く御礼を申し上げます。 D 化 EGCG を化学合成して頂きました東北大学大学院薬学研究科、土井隆行 教授および吉田将人助教に厚く御礼を申し上げます。 本研究に協力された加藤正樹博士、玉國恭平氏をはじめ食品化学分野の各位 に感謝致します。 編入学を許可頂きました株式会社伊藤園中央研究所所長提坂(三種)裕子博 士、株式会社伊藤園人事部部長松永聡氏に厚く御礼を申し上げます。また、支 えてくれた家族、友人、株式会社伊藤園中央研究所所員各位に感謝致します。 159
© Copyright 2026